
- •Лекция 33 фенолы План
- •Классификация и номенклатура
- •Методы получения
- •Физические свойства и строение
- •Химические свойства
- •Получение простых и сложных эфиров фенолов
- •Перегруппировка Кляйзена аллилариловых эфиров
- •Галогенирование
- •Нитрование
- •Нитрозирование
- •Алкилирование и ацилирование по Фриделю-Крафтсу
- •Реакция Вильсмейера-Хаака
- •Реакция Реймера-Тимана
Лекция 33 фенолы План
Классификация и номенклатура.
Методы получения.
Физические свойства и строение.
Химические свойства.
Фенолы – гидроксилпроизводные ароматических углеводородов, в которых группа ОН связана с атомом углерода ароматического ядра.
Классификация и номенклатура
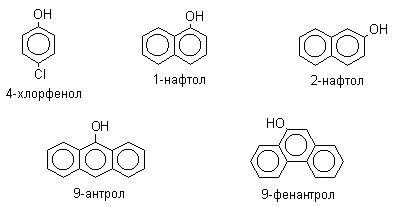
По количеству ароматических ядер в молекуле различают собственно фенолы, а также нафтолы, антролы, фенантролы и др. По числу гидроксильных групп различают одно-, двух-, трех-, многоатомные фенолы.
Названия фенолов образуют от названий соответствующих аренов с добавлением суффикса –ол. Простейший фенол – гидроксибензол С6Н5ОН называют просто фенол. При наличии нескольких заместителей начало нумерации определяет гидроксильная группа и эти соединения рассматриваются как производные фенола. Иногда в соединениях сложного строения наличие гидроксильной группы обозначают префиксом гидрокси-. Многие фенолы имеют тривиальные названия.



Методы получения
Фенол выделяют из каменноугольной смолы. Существует многочисленные синтетические методы получения фенола, промышленные и лабораторные.
Замещение сульфогруппы на гидроксил
![]()
![]()
Наиболее старый промышленный метод получения фенолов заключается в сплавлении щелочных арилсульфонатов с твердым гидроксидом натрия или калия или со сравнительно легкоплавкой смесью этих гидроксидов при 300-350оС.
Хотя точный механизм реакции в расплаве двух ионных соединений неизвестен, ее следует отнести к процессам нуклеофильного ароматического замещения, где гидроксид-ион играет роль нуклеофильного агента, а сульфит-ион - уходящей группы.
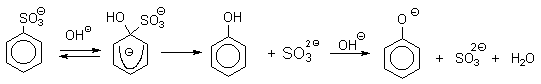
Для получения самого фенола метод щелочного плавления в настоящее время не используется, но он широко используется для получения 2-нафтола, резорцина, ализарина и других фенолов.
2).Замещение галогена на гидроксил
Арилгалогениды, не содержащие активирующих электроноакцепторных заместителей, вступают в реакцию обмена в очень жестких условиях. Фенол получают нагреванием хлорбензола с 15-20%-ным водным раствором гидроксида натрия при 360-390оС и давлении 280-300 атм.
C6H5Cl + 2NaOH 360 C C6H5O-Na+ + NaCl + H2O
C6H5O-Na+ + HCl C6H5OH + NaCl
В этих условиях реакция идет по ариновому механизму (см. лек.№24).
В присутствии солей меди (II), играющих роль катализатора, ариновый механизм полностью подавляется из-за резкого ускорения прямого замещения галогена по SNAr-механизму. Применение солей меди (II) позволяет проводить региоселективное замещение галогена на гидроксил без примеси какого-либо другого изомерного фенола.
![]()
Введение в молекулу арилгалогенида электроноакцепторных заместителей в орто- или пара-положения увеличивают скорость обмена галогена на гидроксил в некатализируемой реакции. Для таких реакций предложен SNAr-механизм замещения.
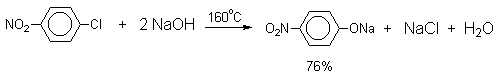
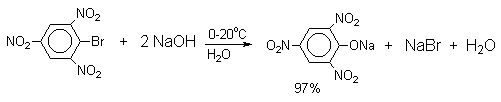
Замещение диазогруппы на гидроксил
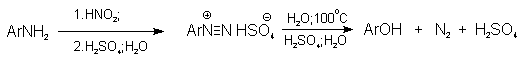
Метод включает диазотирование первичного амина с последующими разложением соли диазония в водном растворе серной кислоты. Замещение диазогруппы на гидроксил протекает по SN1-механизму. Так как промежуточно образующийся арилкатион может реагировать с любым нуклеофилом, имеющимся в реакционной среде, наиболее целесообразно использовать для гидролиза в фенолы гидросульфаты диазония. В качестве побочного продукта при этом образуется эфир ArOSO3H, который легко гидролизуется в фенол. См. также лек. №24 и 43.
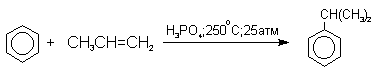
4) Получение фенола из гидропероксида кумола
Современный промышленный метод получения фенола заключается в кислотно-катализируемом разложении гидропероксида кумола. Исходное вещество для всего цикла превращений - кумол получают алкилированием бензола пропиленом по Фриделю-Крафтсу.
Далее кумол окисляют кислородом воздуха при 100-130оС до гидропероксида кумола.

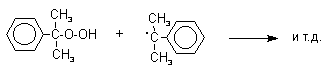
Эта реакция протекает по цепному радикальному механизму с участием кумильного радикала.
![]()
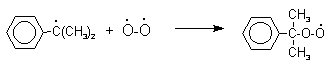

![]()
Разложение гидропероксида кумола до фенола и ацетона проводят в присутствии 1% водной серной кислоты при 50-90оС.
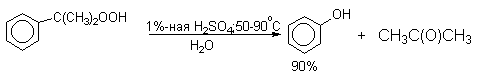
Процесс разложения гидропероксида по своему механизму напоминает перегруппировки карбкатионов. Различие заключается в том, что миграция фенила происходит к положительно заряженному атому кислорода.


В целом это очень экономичный способ получения одновременно двух важнейших продуктов - ацетона и фенола.
