
Алкилирование по Фриделю-Крафтсу
Алкилирование ароматических соединений осуществляют действием алкилгалогенидов в присутствии в качестве катализатора кислот Льюиса (AlBr3, AlCl3, FeCl3, SbCl5, TiCl4, BF3, BCl3, SnCl4 и др.). Самым распространенным катализатором этой реакции является сублимированный хлористый алюминий.
![]()
Механизм реакции можно представить следующей схемой:
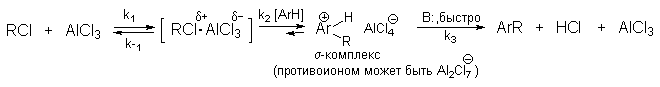
где В: = AlCl4- ; H2O или другое основание.
Скорость реакции лимитируется стадией образования -комплекса.
Точное строение интермедиата (RCl .AlCl3) не известно. Можно представить целый ряд структур от молекулярного комплекса до диссоциированных карбокатионов.
+ -
RClAlCl3 RCl AlCl3 R+AlCl4- R+ + AlCl4-
молекулярный координационный контактная свободные ионы
комплекс комплекс ионная пара
Наиболее вероятно, что строение комплексов RX. MXn постепенно изменяется от структуры координационного комплекса до структуры ионной пары в зависимости от природы R. Участие в реакции молекулярных комплексов и свободных карбокатионов маловероятно.
Способность атома галогена в RX к комплексообразованию с AlCl3 или другой жесткой кислотой Льюиса резко уменьшается от фтора к иоду, вследствие чего активность алкилгалогенидов в качестве алкилирующих агентов в реакции Фриделя-Крафтса уменьшается в ряду RF> RCl> RBr> RI.
Реакционная способность галогенпроизводных зависит также от природы углеводородного радикала и уменьшается в ряду (C6H5)3CX> (C6H5)2CHX> C6H5CH2X> CH2=CHCH2X> R3CX> R2CHX> RCH2X> CH3X.
Алкилирование аренов по Фриделю-Крафтсу как синтетический метод имеет три серьезных недостатка, ограничивающих его применение в органическом синтезе.
Во-первых, реакция имеет низкую селективность по продукту монозамещения, так как первоначально образующийся продукт моноалкилирования более реакционноспособен, чем исходный арен. Алкилирование аренов алкилгалогенидами при соотношении реагентов, близком к эквимолярному, приводит к образованию значительного количества продуктов полиалкилирования. Для того чтобы свести полиалкилирование к минимуму, используют большой избыток ароматического углеводорода, который выполняет роль и реагента, и растворителя.
Во-вторых, в ходе реакции происходит изомеризации алкилирующего агента, в результате чего образуется смесь изомерных продуктов алкилирования. Классическим примером является алкилирование бензола н-пропилхлоридом, приводящее к смеси н-пропил- и изопропилбензолов.
П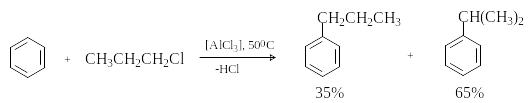
 ричина
образования изопропилбензола -
изомеризация 1-хлорпропана в 2-хлорпропан
под действием кислоты Льюиса.
ричина
образования изопропилбензола -
изомеризация 1-хлорпропана в 2-хлорпропан
под действием кислоты Льюиса.
Поскольку вторичные алкилгалогениды в реакции алкилирования ароматических углеводородов более реакционноспособны, чем первичные, доля изомеризованного продукта оказывается выше, чем алкилбензола с первичной алкильной группой. По этой причине н-алкилбензолы целесообразно получать не алкилированием, а ацилированием аренов по Фриделю-Крафтсу с последующим восстановлением (см. далее).
Третье ограничение, препятствующее применению реакции алкилирования по Фриделю-Крафтсу, связано с миграцией алкильных групп в конечном продукте реакции. Алкилирование по Фриделю-Крафтсу относится к немногочисленной группе обратимых реакций электрофильного ароматического замещения, подчиняющихся термодинамическому контролю, когда в продуктах реакции преобладает более стабильные 1,3-диалкил- или 1,3,5,-триалкилбензолы.

П реимущественное
образование продуктов мета-замещения
связано с миграцией алкильных групп в
первоначально образующихся продуктах
алкилирования. Так, при нагревании
п-ксилола
в присутствии галогеноводорода и кислоты
Льюиса образуется равновесная смесь,
в которой преобладает более стабильный
м-ксилол.
реимущественное
образование продуктов мета-замещения
связано с миграцией алкильных групп в
первоначально образующихся продуктах
алкилирования. Так, при нагревании
п-ксилола
в присутствии галогеноводорода и кислоты
Льюиса образуется равновесная смесь,
в которой преобладает более стабильный
м-ксилол.
В жестких условиях изомеризация алкилбензолов приобретает межмолекулярный характер, так что сами они могут выступать в качестве алкилирующих реагентов (переалкилирование).
C6H4(C2H5)2 + C6H6 [AlCl3] 2C6H5C2H5
К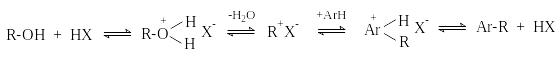 роме
алкилгалогенидов в качестве алкилирующих
реагентов используют спирты в присутствии
протонных кислот или кислот Льюиса:
(H3PO4,
H2SO4,
BF3):
роме
алкилгалогенидов в качестве алкилирующих
реагентов используют спирты в присутствии
протонных кислот или кислот Льюиса:
(H3PO4,
H2SO4,
BF3):
и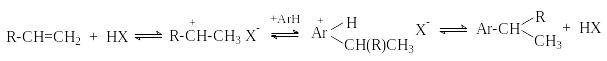 ли
алкены в присутствии протонных кислот
(H3PO4,
HF) или систем HCl-AlCl3;
HF-BF3:
ли
алкены в присутствии протонных кислот
(H3PO4,
HF) или систем HCl-AlCl3;
HF-BF3:
В этих случаях электрофильными реагентами являются карбокатионы или близкие к ним ионные пары. Алкилирование спиртами и алкенами имеет те же недостатки, что и алкилирование алкилгалогенидами.
Ароматические соединения, содержащие электроноакцепторные заместители (NO2, NO,CN,COOR и др.), не алкилируются в условиях реакции Фриделя-Крафтса. Ароматические амины и фенолы связывают кислоты Льюиса в нереакционноспособный донорно-акцепторный комплекс, где неподеленная пара электронов кислорода или азота координируется с атомом металла кислоты Льюиса. Поэтому для алкилирования этих соединений в ароматическое ядро используют другие методы.
