
Лекция №22
ЭЛЕКТРОФИЛЬНОЕ АРОМАТИЧЕСКОЕ ЗАМЕЩЕНИЕ
План
Механизм SNAr.
Ориентация и реакционная способность.
Основные реакции электрофильного замещения
В реакциях электрофильного замещения атакующей частицей являются катионы или молекулы с вакантной орбиталью, а также молекулы с сильно поляризованной связью, которая разрывается гетеролитически в процессе реакции. Как правило, электрофильные частицы образуются непосредственно в реакционной смеси, что будет рассмотрено далее на конкретных примерах. Уходящая группа в таких реакциях отщепляется, оставляя субстрату свою пару электронов и, следовательно, должна быть слабой кислотой Льюиса. В реакциях ароматического электрофильного замещения такой группой чаще всего служит протон.
![]()
Механизм ароматического электрофильного замещения.
Б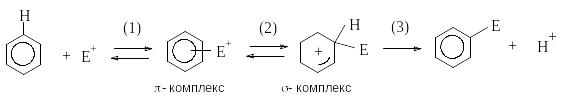 ольшинство
реакций ароматического электрофильного
замещения протекает по единому механизму,
получившему название механизм с участием
аренониевых ионов.
ольшинство
реакций ароматического электрофильного
замещения протекает по единому механизму,
получившему название механизм с участием
аренониевых ионов.
Р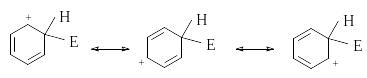 еакция
начинается с образования донорно-акцепторного
комплекса между ареном и электрофилом
(-комплекс),
в котором арен выступает в роли
-основания.
Далее -комплекс
перегруппировывается в -комплекс
(аренониевый ион), содержащий -связь
углерод-электрофил. При образовании
аренониевого иона ароматическая
-система
нарушается и образуется незамкнутая
сопряженная система циклогексадиенильного
катиона, в котором атом углерода,
образующий связь с электрофилом,
находится в состоянии sp3-гибридизации,
а положительный заряд делокализован
по сопряженной системе. Делокализация
положительного заряда происходит в
основном за счет орто-
и пара-положений
по отношению к вступающему электрофилу,
что может быть показано с помощью набора
резонансных структур:
еакция
начинается с образования донорно-акцепторного
комплекса между ареном и электрофилом
(-комплекс),
в котором арен выступает в роли
-основания.
Далее -комплекс
перегруппировывается в -комплекс
(аренониевый ион), содержащий -связь
углерод-электрофил. При образовании
аренониевого иона ароматическая
-система
нарушается и образуется незамкнутая
сопряженная система циклогексадиенильного
катиона, в котором атом углерода,
образующий связь с электрофилом,
находится в состоянии sp3-гибридизации,
а положительный заряд делокализован
по сопряженной системе. Делокализация
положительного заряда происходит в
основном за счет орто-
и пара-положений
по отношению к вступающему электрофилу,
что может быть показано с помощью набора
резонансных структур:
Аренониевый ион является высокореакционноспособной частицей, которая может стабилизироваться либо за счет присоединения нуклеофила, как это происходит при электрофильном присоединении к алкенам, либо путем отщепления протона под действием основания. Последнее направление энергетически более выгодно, так как приводит к восстановлению ароматической системы. Именно оно и реализуется при ароматическом электрофильном замещении (стадия 3).
Стадия образования -комплекса протекает быстро и обратимо и не определяет скорость процесса в целом. Для большинства реакций электрофильного скорость-определяющей является стадия образования -комплекса.
Х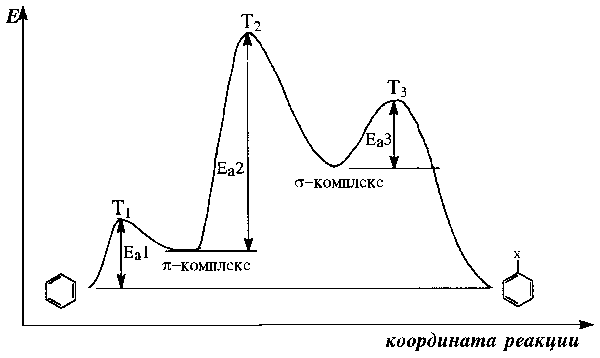 од
реакции и ее механизм иллюстрирует
энергетическая диаграмма, представленная
на рис.18.1.
од
реакции и ее механизм иллюстрирует
энергетическая диаграмма, представленная
на рис.18.1.
Рис.18.1. Энергетическая диаграмма реакции электрофильного ароматического замещения.(Еа – энергии активации, Т – переходные состояния соответствующих стадий)
Образование аренониевых ионов как интермедиатов в реакциях ароматического электрофильного замещения подтверждается экспериментами по их получению в суперкислых средах, где в качестве электрофила выступает Н+, а противоионами являются комплексные ионы с низкой основностью. В системах ArH - HF-BF3 или ArH-HF-SbF5 при низкой температуре образуются аренониевые ионы, строение которых было установлено с помощью ЯМР-спектроскопии на ядрах 1Н и 13С.
![]()
![]()
Устойчивость -комплексов очень сильно зависит от числа и природы заместителей в бензольном кольце. Устойчивость повышается при наличии в ароматическом ядре электронодонорных заместителей, участвующих в делокализации положительного заряда, а также при наличии комплексных противоионов типа BF4- или SbF6- (слабые основания). Подобного рода -комплексы были зафиксированы при низкой температуре для многих реакций электрофильного замещения в ароматическом кольце. Ниже приводятся некоторые наиболее типичные примеры.
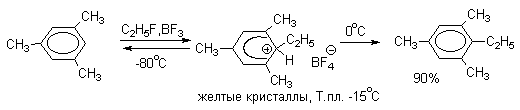


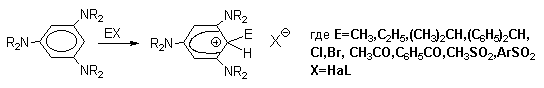
Для многих реакций ароматического электрофильного замещения наблюдается корреляция между устойчивостью -комплекса и скоростью реакции. Это означает, что скорость определяется стадией образования -комплекса и -комплекс является хорошей моделью переходного состояния. Образование -комплекса представляет собой быструю обратимую стадию, не оказывающую существенного влияния на скорость реакции в целом. Можно совершенно адекватно описать реакцию, если из кривой потенциальной энергии (рис.18.1) исключить -комплекс и рассматривать лишь положение -комплекса на координате реакции.
В общем случае реакцию электрофильного замещения можно представить следующей кинетической схемой (без учета образования -комплекса) :
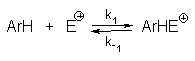
![]()
Применяя принцип стационарности, получаем следующее выражение для наблюдаемой скорости:
![]()
![]()
Из этого кинетического уравнения вытекают следующие частные случаи.
1) Если k2[B] >>k-1, то, пренебрегая первым членом в знаменателе, будем иметь выражение для скорости:
![]()
В этом случае скорость-определяющей стадией является стадия образования -комплекса, что и наблюдается в большинстве реакций электрофильного замещения.
2) Если k-1 >> k2[B], то, пренебрегая вторым членом в знаменателе, получаем выражение для скорости:
![]()
В этом случае лимитирующей является стадия отрыва протона от -комплекса и должен наблюдаться кинетический изотопный эффект (замещение в дейтерированном субстрате протекает медленне, чем в недейтерированном), так как в лимитирующей стадии происходит разрыв связи С-Н. Стадия отщепления протона от -комплекса может стать скорость-определяющей в результате стерических затруднений, возникающих при подходе основания к отщепляемому протону, или при низкой концентрации основания, отщепляющего протон.
Таким образом:
Большинство реакций электрофильного замещения имеют общий механизм присоединения - отщепления с образованием в качестве нестабильных короткоживущих интермедиатов аренониевых ионов (-комплексов).
При смешивании аренов с электрофилами образуются слабые -комплексы, однако нет ни одного бесспорного случая, когда было бы точно доказано, что лимитирующей стадией всей реакции является образование -комплекса.
Стадия отщепления протона от -комплекса во многих случаях является быстрой. Однако в некоторых случаях, например, при недостатке основания, эта стадия замедляется. Тогда наблюдается кинетический изотопный эффект водорода.
