
Основные реакции электрофильного замещения
Нитрование
В качестве нитрующих агентов используют азотную кислоту в смеси с серной кислотой (нитрующую смесь) или азотную кислоту в органических растворителях (уксусной кислоте, нитрометане). Из других реагентов следует упомянуть соли нитрония (NO2+BF4-, NO2+ClO4-) и ацетилнитрат CH3C(O)ONO2.
Установлено, что в электрофильном нитровании независимо от природы нитрующего агента активным электрофилом является ион нитрония NO2+ . В избытке концентрированной серной кислоты происходит количественное превращение азотной кислоты в гидросульфат нитрония, что доказано различными физико-химическими методами:
![]()
В отсутствие серной кислоты ион нитрония образуется в результате автопротолиза азотной кислоты.
2HNO3 NO + NO + H2O
При использовании в качестве реагента нитрующей смеси концентрация ионов нитрония в растворе всегда достаточно высока и при избытке реагента постоянна, поэтому нитрование можно рассматривать как двухстадийный процесс.

Медленной стадией этого двухстадийного процесса является образование -комплекса. Это доказывается отсутствием кинетического изотопного эффекта водорода при нитровании аренов и дейтероаренов. Реакция имеет первый порядок по субстрату.
При нитровании азотной кислотой в органических растворителях образование катиона нитрония протекает значительно медленнее. В этом случае для малореакционноспособных субстратов скорость реакции по-прежнему определяется стадией образования -комплекса, а для высокореакционноспособных соединений суммарная скорость процесса лимитируется скоростью образования катиона нитрония. В последнем случае реакция имеет нулевой порядок по субстрату.
Незамещенный бензол обычно нитруют смесью концентрированных азотной и серной кислот при 45-50оС.

Алкилбензолы нитруется в более мягких условиях, чем бензол. На примере реакции нитрования алкилбензолов отчетливо прослеживается влияние пространственных факторов на направление электрофильного замещения. Так, при нитровании толуола орто-изомер образуется в качестве основного продукта, а при переходе к этил-, изопропил- и особенно к трет-бутилбензолу его выход существенно уменьшается.
Таблица 18.2. Влияние пространственых факторов на соотношение орто-, пара-изомеров в реакции нитрования (NO2+)
С6H5-R
|
Замещение в положения, % |
||
орто- |
пара- |
мета- |
|
C6H5-CH3 |
57 |
40 |
3 |
C6H5-C2H5 |
45 |
48 |
7 |
C6H5-CH(CH3)2 |
30 |
62 |
8 |
C6H5-C(CH3)3 |
12 |
79 |
9 |
Реакции нитрования протекают селективно по продукту монозамещения, так как нитрогруппа дезактивирует ароматическое кольцо, снижая скорость введения второго заместителя в 107раз.
Галогенирование
В качестве электрофильных галогенирующих агентов используются молекулярные галогены или комплексы галогенов с кислотами Льюиса (FeCl3, FeBr3, AlCl3, AlBr3, галогениды Ga,Sb,Sn,TiCl4 и др.).
Галогенирование молекулярными галогенами эффективно лишь для аренов с активирующими заместителями в ядре (полиалкилбензолов, фенолов, простых эфиров одно- и многоатомных фенолов, ароматических аминов). Механизм хлорирования аренов молекулярным хлором может быть представлен следующей схемой.
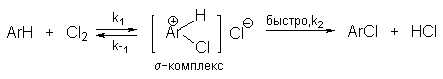
Галогенирование менее активных субстратов возможно при катализе кислотами Льюиса, которые поляризуют связь галоген-галоген и увеличивают электрофильность реагента. Атакующим агентом в этом случае, по-видимому, является комплекс молекулы галогена с кислотой Льюиса, например, [Cl+...Cl…FeCl3-]. Не получено прямых доказательств участия в этих реакциях катионов Cl+ или Br+ как кинетически независимых частиц.

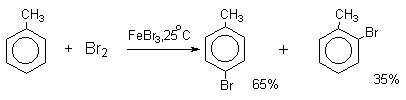
Бензол хлорируется и бромируется галогенами в присутствии галогенидов железа при комнатной температуре. Использование более активных катализаторов (галогенидов алюминия) и высоких температур приводит к образования ди- и полигалогенбензолов. Введение хлора или брома в бензольное кольцо уменьшает скорость дальнейшего замещения не более чем в 7-8 раз. Поэтому хлорирование и бромирование протекают менее селективно по продукту монозамещения, чем нитрование.
Толуол в реакциях электрофильного галогенирования существенно реакционноспособнее, чем бензол. При бромировании толуола получается смесь пара- и орто-изомеров в соотношении ~2:1, и совсем не получается мета-изомера, а при хлорировании орто- и пара-изомеры образуются в примерно равных количествах.

М олекулярный
иод является слишком слабым электрофильным
агентом. Только очень активные
ароматические соединения, такие, как
ароматические амины или фенолят-ион
реагируют непосредственно с I2.
В качестве более активного иодирующего
агента иногда используют хлорид иода
ICl.
олекулярный
иод является слишком слабым электрофильным
агентом. Только очень активные
ароматические соединения, такие, как
ароматические амины или фенолят-ион
реагируют непосредственно с I2.
В качестве более активного иодирующего
агента иногда используют хлорид иода
ICl.
Удобным методом иодирования ароматических соединений является использование смеси молекулярного иода и окислителей (HIO4, HNO3). Окислители превращают иод в катион I+, который является сильным электрофильным реагентом.
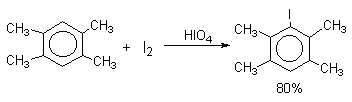
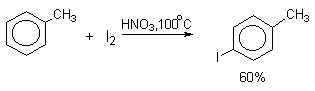
Ввиду чрезвычайной активности фтора, прямое фторирование практически не применяют для введения фтора в ароматическое кольцо.
