
- •Классификация
- •Электронное строение бензола. Ароматичность
- •1. Строение бензола
- •Кекуле
- •2. Концепция ароматичности Хюккеля
- •Метод молекулярных орбиталей Хюккеля
- •Графический метод Фроста
- •3. Критерии ароматичности
- •Структурный критерий
- •4. Аннулены
- •Аннулены, содержащие «хюккелевское» число электронов
- •[14]-Аннулен
- •[18]-Аннулен
- •Аннулены, содержащие «антихюккелевское» числоэлектронов
- •[8]-Аннулен
- •5. Ароматические ионы
- •Циклопропенил-катион
- •Циклопентадиенид-анион
- •Катион тропилия
- •Циклопропенид-анион - не получен
- •Циклопропенид-
- •[8]-Аннулен
- •Циклопропенил-
А Р Е Н Ы
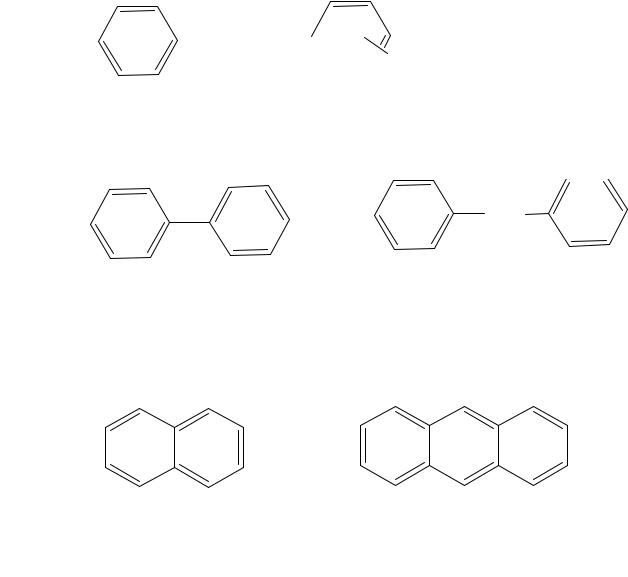
Классификация
• моноядерные арены (бензол и его гомологи)

 R
R
• полиядерные арены с изолированными ядрами
|
CH2 |
дифенил |
дифенилметан |
• полиядерные арены с конденсированными ядрами
нафталин |
антрацен |
Электронное строение бензола. Ароматичность
Ароматичность – это понятие, которое характеризует совокупность структурных и энергетических свойств, а также особенности реакционной способности циклических структур с системой сопряженных связей.

1. Строение бензола
Бензол выделен М.Фарадеем (1825 г.) и синтезирован Э. Мичерлихом (1833 г):
|
CaO, t |
|
C6H5COOH |
|
C6H6 |
|
||
|
- CO2 |
|
Экспериментальные данные:
•молекулярная формула С6Н6
•3 изомера у дизамещенного бензола
•инертность в реакциях присоединения

Кекуле |
Äüþ àð |
Ладен бург |
(1865 ã) |
(1867 ã) |
(1869 ã) |
èëè

2. Концепция ароматичности Хюккеля
Правило Хюккеля: плоские моноциклические замкнутые сопряженные системы, содержащие (4n+2) электронов, являются ароматическими, а содержащие 4n электронов -
антиароматическими (n= 0,1,2…)
áåí çî ë |
цикло бутадиен |
6 электро н о в |
4 электро н а |
аро м атический |
ан тиаро м атический |
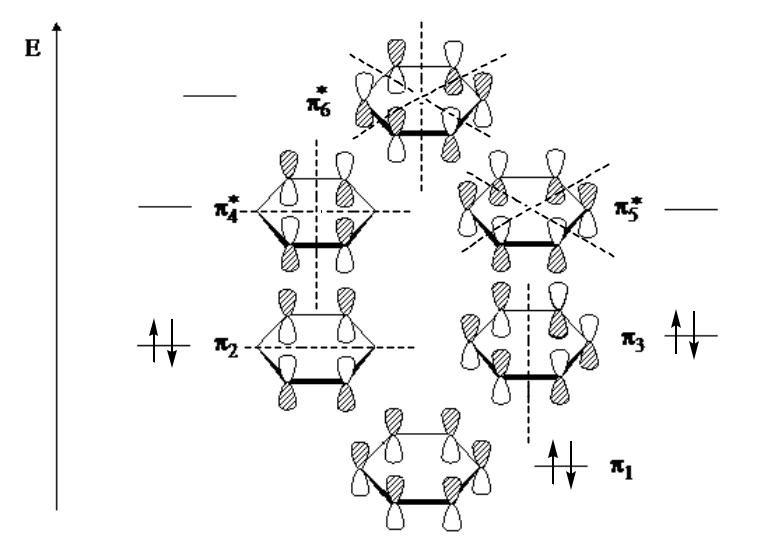
Метод молекулярных орбиталей Хюккеля
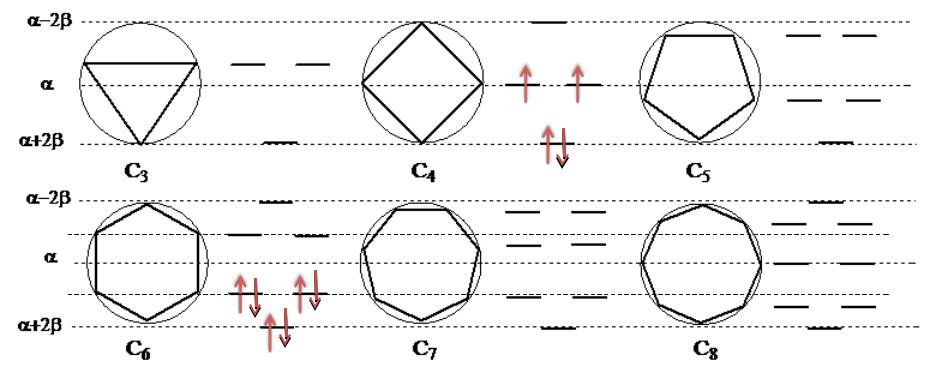
Графический метод Фроста
циклобутадиен
бензол
E C H ) = 6 |
E C H ) = 4 |
6 6 |
4 4 |
E äåë C6H6) = E C6H6) - 3E C2H4) =
3. Критерии ароматичности
• Энергетический критерий
Ароматичность означает стабилизацию (понижение энергии) за счет циклической делокализации электронов.
В антиароматических системах делокализация электронов приводит к дестабилизации (повышению энергии).
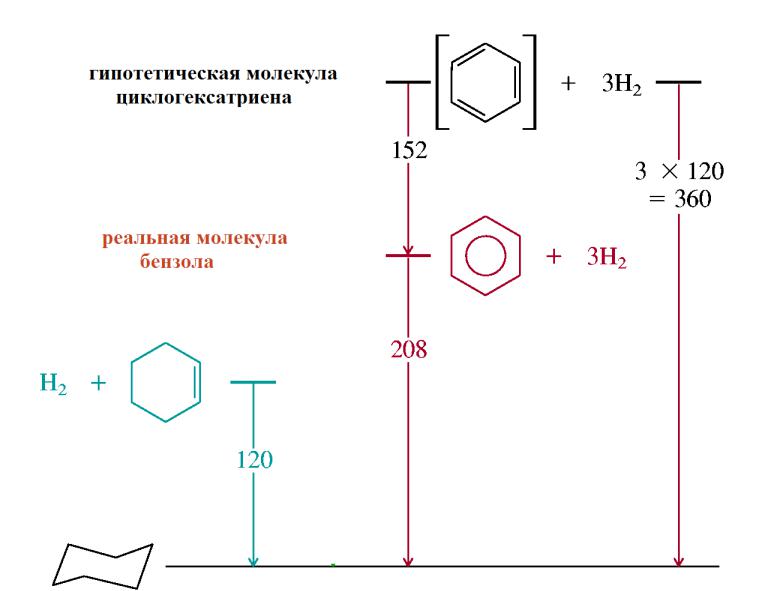
E äåë = H(C6H6) - 3 H(C6H10) = - 208 - 3(-120) = 152 êÄæ/ì î ëü
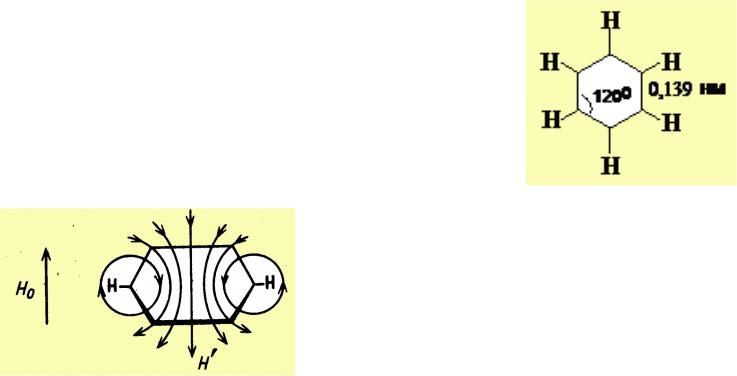
Структурный критерий
•плоское строение
•выравнивание длин связей
Магнитный критерий
Наблюдается сдвиг сигналов в ПМР-спектрах:
•для внешних протонов – в слабое поле,
•для внутренних протонов – в сильное поле относительно сигналов олефиновых протонов
Углеводород |
Химический сдвиг, |
|
, м.д. |
|
|
этилен |
5,29 |
|
|
бензол |
7,27 |
|
|
