
- •Лекция 14.Комплексные соединения
- •1.Понятие о комплексном соединении
- •2.Структура комплексных соединений
- •3.Номенклатура комплексных соединений
- •4.Классификация комплексных соединений
- •4.1.Комплексные соединения, содержащие
- •4.2.Комплексные соединения, содержащие ионные лиганды
- •4.3. Циклические комплексные соединения
- •4.4. Многоядерные комплексные соединения
- •5.Изомерия комплексных соединений
- •6.Равновесия в растворах комплексных соединений
- •7.Квантово-механические методы трактовки химической связи в комплексных соединениях
- •7.1. Метод валентных связей
- •7.2. Теория кристаллического поля
- •8.Способность элементов периодической системы к комплексообразованию
- •9. Применение комплексных соединений
7.2. Теория кристаллического поля
В отличие от MВC теория кристаллического поля предполагает, что связь между комплексообразователем и лигандами чисто ионная. В ТКП комплексное соединение рассматривается как устойчивая многоатомная система, состоящая из иона-комплексообразователя и окружающих его неподвижных точечных зарядов или точечных диполей. Размер и электронное строение лигандов в ТКП не принимаются во внимание. Лиганды в результате электростатического взаимодействия с комплексообразователем ориентированы в пространстве так, чтобы достигалась минимальная энергия взаимного отталкивания этих зарядов. Это условие выполняется, если лиганды располагаются в вершинах октаэдра (при к.ч.=6), тетраэдра или плоского квадрата (при к.ч.=4). Находящиеся вокруг комплексообразователя, лиганды создают электростатическое поле, называемое кристаллическим полем. Под действием этого поля изменяется электронная структура комплексообразователя. Согласно ТКП в «свободном» комплексообразователе все пять валентных d-орбиталей имеют одинаковую энергию, т.е. вырождены, и энергия располагающихся на них электронов тоже будет одинакова, т.е. d-электроны занимают один энергетический уровень.
Если этот комплексообразователь поместить в сферически симметричное поле отрицательного заряда, то в результате возникающего отталкивания энергия у всех имеющихся в комплексообразователе d-электронов повысится. Но это повышение энергии на величину Ео одинаково для всех d-электронов. Поэтому вырождение их энергии и в этом случае сохраняется. Повышение энергии компенсируется при комплексообразовании за счет уменьшения энергии при образовании связей комплексообразователя с лигандами.
Совсем иная ситуация складывается при окружении комплексообразователя лигандами, создающими вокруг него электростатическое (кристаллическое) поле несферической симметрии. Между электронами, находящимися на d-орбиталях комплексообразователя, и лигандами (носителями отрицательного заряда) возникает отталкивание, приводящее по-прежнему к увеличению энергии d-электронов. Но воздействие лигандов на различные d-орбитали уже не одинаково. Энергия электронов на d-орбиталях, расположенных близко к лигандам, возрастает в большей мере, чем энергия электронов на d-орбиталях, более удаленных от лигандов, т.е. происходит расщепление d-подуровня на два - с большей и меньшей энергией. Характер этого расщепления определяется симметрией кристаллического поля, создаваемого лигандами.
Рассмотрим действие лигандов на d-орбитали комплексообразователя при октаэдрическом и плоскоквадратном расположении лигандов.
В
случае октаэдрического расположения
лигандов орбитали
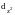 и
и
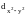 ,
вытянутые вдоль координатных осей,
располагаются близко к лигандам и
подвергаются сильному воздействию поля
лигандов(рис.5.1)
,
вытянутые вдоль координатных осей,
располагаются близко к лигандам и
подвергаются сильному воздействию поля
лигандов(рис.5.1)
Р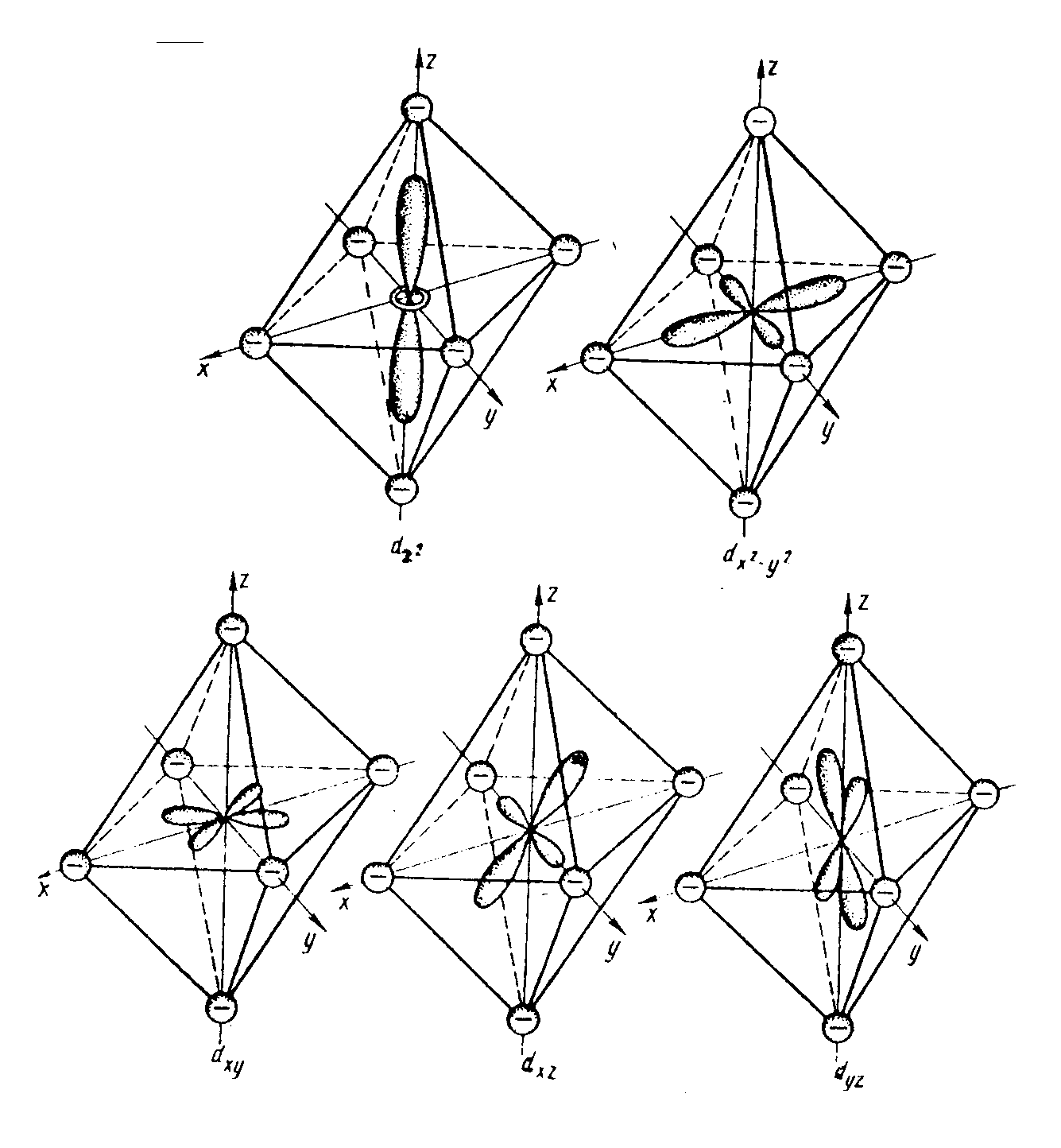 ис.5.1.Орбитали
ис.5.1.Орбитали
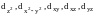
в октаэдрическом поле лигандов
Эти
орбитали имеют энергию, превышающую
энергию основного подуровня. Их обозначают
еg.
Орбитали
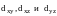 расположены между осями координат и
находятся дальше от лигандов. Они имеют
энергию ниже основного подуровня. Эти
орбитали принято обозначать t2g.
На рис. 5.2.а показана диаграмма расщепления
основного энергетического d-подуровня
комплексообразователя при октаэдрическом
расположении лигандов.
расположены между осями координат и
находятся дальше от лигандов. Они имеют
энергию ниже основного подуровня. Эти
орбитали принято обозначать t2g.
На рис. 5.2.а показана диаграмма расщепления
основного энергетического d-подуровня
комплексообразователя при октаэдрическом
расположении лигандов.
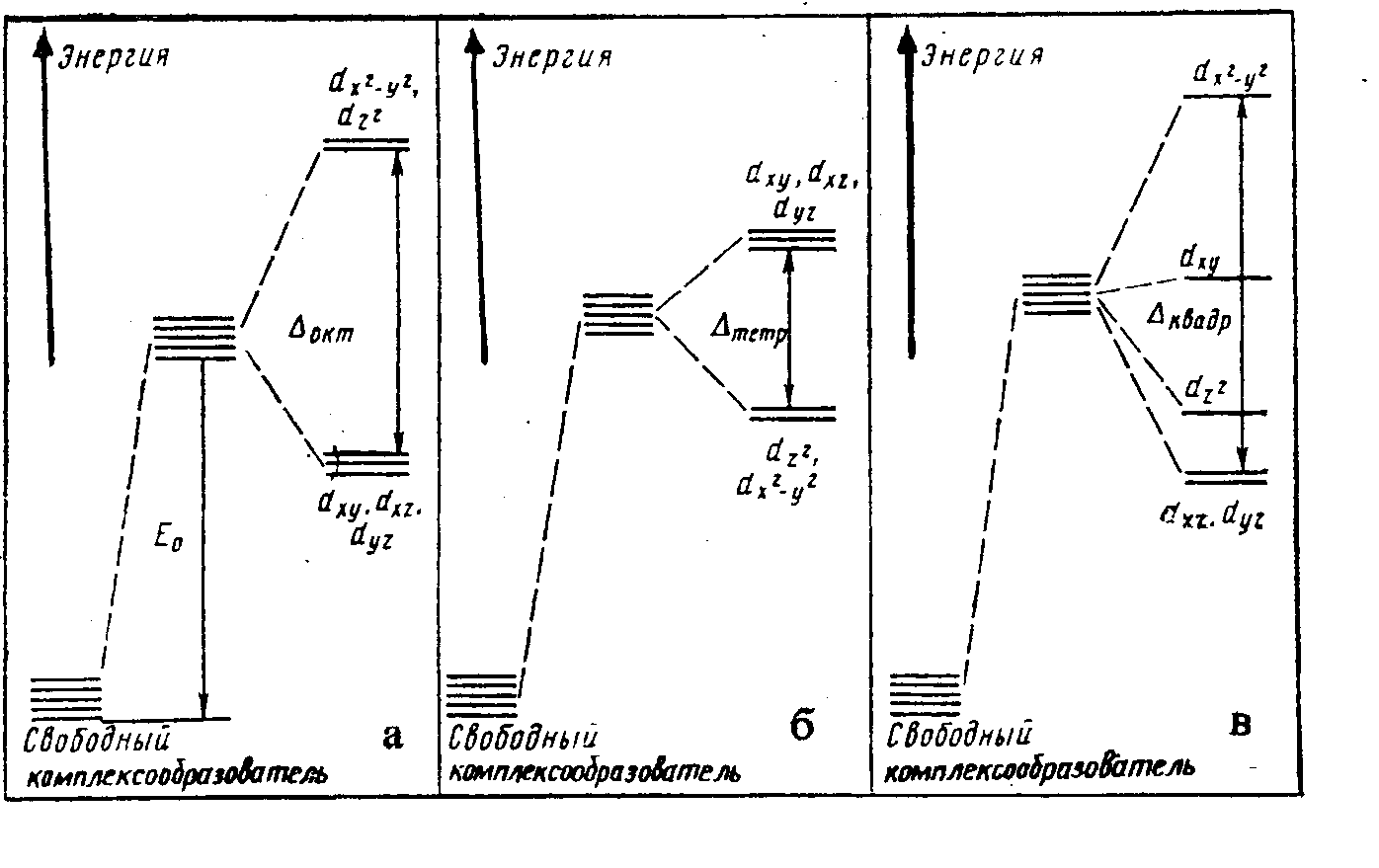
Рис.5.2. Диаграмма энергетических подуровней, образующихся в результате
расщепления d-орбиталей комплексообразователя в электростатическом поле
лигандов октаэдрической (а), тетраэдрической (б) и плоскоквадратной (в)
конфигурации.
При
тетраэдрическом окружении
комплексообразователя лигандами
орбитали
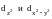 ,
расположенные вдоль осей, находятся,
наоборот, дальше от лигандов и имеют
энергию меньше энергии основного
подуровня, а орбитали dxy,
dxz
и dyz
расположены между осями и имеют энергию
выше энергии основного подуровня
(рис.5.2б).
,
расположенные вдоль осей, находятся,
наоборот, дальше от лигандов и имеют
энергию меньше энергии основного
подуровня, а орбитали dxy,
dxz
и dyz
расположены между осями и имеют энергию
выше энергии основного подуровня
(рис.5.2б).
Аналогично можно рассмотреть расщепление энергетического подуровня комплексообразователя в поле лигандов плоскоквадратной конфигурации (рис.5.2в).
Разность
в энергии между подуровнями
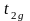 и
и
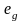 называется энергией
расщепления
и обозначается .
Значение
обычно определяют спектроскопическим
путем и измеряют в см-1.
называется энергией
расщепления
и обозначается .
Значение
обычно определяют спектроскопическим
путем и измеряют в см-1.
Значения энергии расщепления зависят от природы лигандов, природы комплексообразователя, его степени окисления, конфигурации комплекса.
При одном и том же комплексообразователе и одинаковой пространственной конфигурации комплексов значение энергии расщепления увеличивается при усилении создаваемого лигандами поля. Экспериментальное исследование спектров комплексных соединений и квантово-механические расчеты позволили определить значение для разных лигандов. По способности вызывать расщепление d-подуровня комплексообразователя в октаэдрических комплексах (по силе создаваемого кристаллического поля) лиганды могут быть поставлены в следующий ряд:
 >
>
>
>
>
> >
>
>
>
>
>
>
>
>
>
> > > .
Данный ряд называется спектрохимическим рядом лигандов. Эта же последовательность практически сохраняется и при других пространственных конфигурациях лигандов.
Теория кристаллического поля позволяет объяснить многие физико-химические свойства комплексов (магнитные, оптические и др.), их геометрическую конфигурацию. Для этого необходимо знать характер распределения валентных электронов по d-орбиталям комплексообразователя, находящегося в определенном поле лигандов. Он определяется величиной и энергией спаривания электронов Р (энергия, которую необходимо затратить, чтобы перевести электрон с орбитали, где он находится один, на орбиталь, где уже имеется электрон).
Если
энергия электронного спаривания больше,
чем энергия расщепления, то распределение
d-электронов
происходит в соответствии с правилом
Хунда. Электроны по одному заполняют
орбитали на подуровнях
и
,
возникших после расщепления d
- подуровня в последовательности
увеличения их энергии. И только при
большом числе валентных d-электронов
комплексообразователя происходит
размещение на этих орбиталях вторых
электронов. Так происходит, когда лиганды
образуют слабое кристаллическое поле
( ).
При
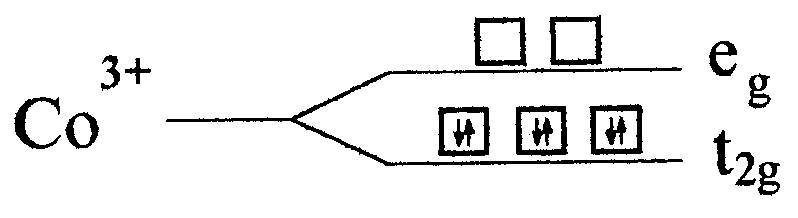
).
При
этом образуются высокоспиновые комплексы. Например, в комплексном ионе
реализуется следующая электронная конфигурация:

Опыт показывает, что действительно парамагнитен.
Если
Р,
то распределение d
-электронов происходит иначе. Сначала
полностью заполняются электронами
орбитали на подуровне с меньшей энергией
и только затем - орбитали подуровня с
большей энергией. Это случай, когда
комплекс содержит лиганды, формирующие
сильное кристаллическое поле. При этом
образуются низкоспиновые
комплексы.
Например, в комплексном ионе
реализуется низкоспиновая конфигурация
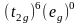 ,
не имеющая неспаренных электронов:
,
не имеющая неспаренных электронов:
При образовании комплексов в результате размещения электронов комплексообразователя на наиболее низких энергетических подуровнях, полученных при расщеплении основного d-подуровня комплексообразователя, под влиянием поля лигандов достигается тот или иной выигрыш энергии. Его называют энергией стабилизации кристаллическим полем. Величина этой энергии определяется электронной структурой комплексообразователя и положением лиганда в спектрохимическом ряду.
ТКП
с успехом объясняет происхождение
спектров поглощения комплексных
соединений и их цвет. Рассмотрим в
качестве примера возникновение спектра
поглощения комплексного иона
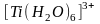 .
Ион
.
Ион
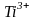 имеет
внешнюю электронную конфигурацию d1.
Согласно ТКП d-электрон
занимает в октаэдрическом поле низкий
по энергии подуровень
имеет
внешнюю электронную конфигурацию d1.
Согласно ТКП d-электрон
занимает в октаэдрическом поле низкий
по энергии подуровень
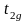 .
При облучении светом раствора, содержащего
комплексный ион
,
происходит поглощение квантов света с
частотой =/h.
Вследствие сравнительно небольшой
разности энергии между
и
орбиталями под действием света происходит
переход электрона с
-орбитали
на
-орбиталь:
.
При облучении светом раствора, содержащего
комплексный ион
,
происходит поглощение квантов света с
частотой =/h.
Вследствие сравнительно небольшой
разности энергии между
и
орбиталями под действием света происходит
переход электрона с
-орбитали
на
-орбиталь:
![]()
В спектре поглощения появляется область, в которой интенсивность проходящего света меньше, чем интенсивность света падающего. Эту область спектра называют полосой поглощения. Для рассматриваемого иона эта полоса (рис.5.3) находится в видимой области спектра
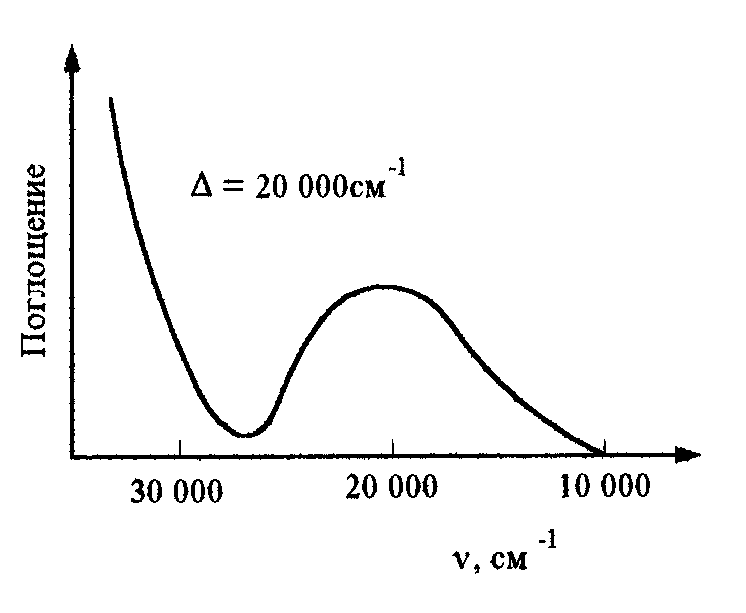
Рис 5.3.Спектр поглощения комплексного иона [Ti(H2O)6]3+
и обуславливает фиолетовое окрашивание твердого и его растворов.
Металлические
ионы, не испытывающие расщепление
подуровней в кристаллическом поле
лигандов (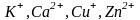 ),
образуют бесцветные аквакомплексы.
Высокоспиновые комплексы
),
образуют бесцветные аквакомплексы.
Высокоспиновые комплексы
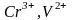 ,
орбитали которых испытывают наибольшее
расщепление кристаллическим полем
лигандов, имеют фиолетовую окраску.
,
орбитали которых испытывают наибольшее
расщепление кристаллическим полем
лигандов, имеют фиолетовую окраску.
ТКП также может объяснить стереохимию комплексных соединений и другие их свойства. Существенным ограничением ТКП является невозможность описания с её помощью -связей. Это связано с необходимостью учета электронного строения лигандов. ТКП, усовершенствованную таким образом, что она становится способной учитывать индивидуальную структуру лигандов и перекрывание валентных орбиталей комплексообразователя и лигандов, называют теорией поля лигандов.
