
- •Лекция 14.Комплексные соединения
- •1.Понятие о комплексном соединении
- •2.Структура комплексных соединений
- •3.Номенклатура комплексных соединений
- •4.Классификация комплексных соединений
- •4.1.Комплексные соединения, содержащие
- •4.2.Комплексные соединения, содержащие ионные лиганды
- •4.3. Циклические комплексные соединения
- •4.4. Многоядерные комплексные соединения
- •5.Изомерия комплексных соединений
- •6.Равновесия в растворах комплексных соединений
- •7.Квантово-механические методы трактовки химической связи в комплексных соединениях
- •7.1. Метод валентных связей
- •7.2. Теория кристаллического поля
- •8.Способность элементов периодической системы к комплексообразованию
- •9. Применение комплексных соединений
5.Изомерия комплексных соединений
Для комплексных соединений характерно явление изомерии. Оно заключается в существовании соединений одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам. Такие соединения называются изомерами. Изучение изомерии позволило впервые установить пространственное строение таких соединений. Рассмотрим основные типы изомерии комплексных соединений.
Пространственная изомерия. Она обусловлена существованием соединений, имеющих одинаковый порядок связей атомов, но различное их расположение. Пространственная изомерия бывает двух видов: геометрическая и оптическая.
Геометрическая изомерия заключается в том, что комплекс, содержащий неодинаковые лиганды, может существовать в нескольких различных формах в зависимости от пространственного размещения лигандов во внутренней сфере комплекса. К геометрической изомерии в первую очередь относится цис-транс-изомерия в плоско-
квадратных
комплексах
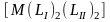 и октаэдрических -
и октаэдрических -
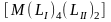 .
Например, для
возможны два изомера:
.
Например, для
возможны два изомера:

цис-изомер транс-изомер
(оранжево-желтый) (светло-желтый)
При
октаэдрическом расположении шести
лигандов для комплексного соединения
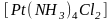 возможны такие два изомера:
возможны такие два изомера:
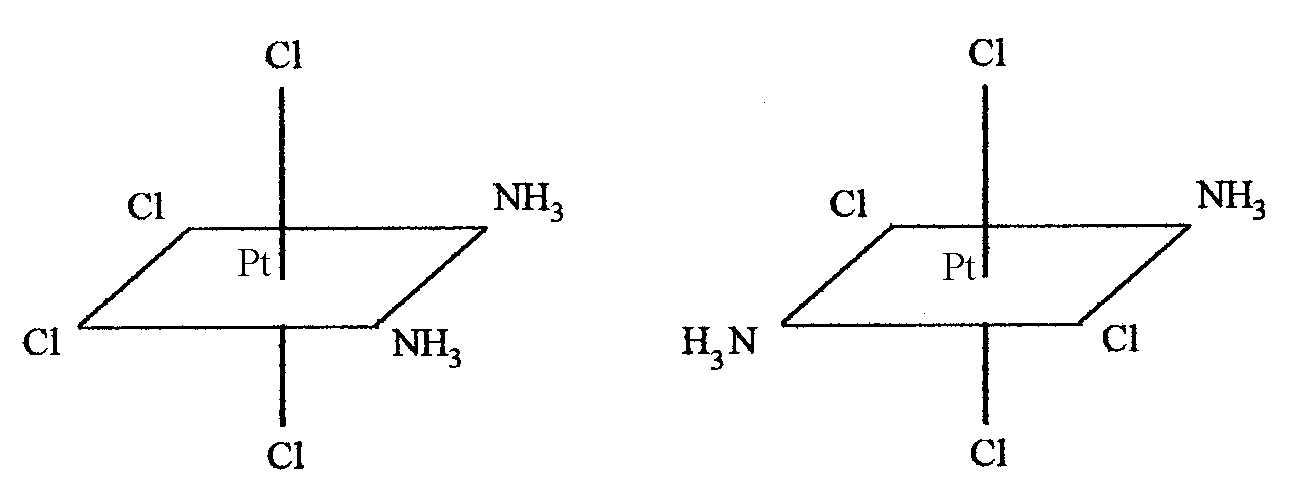 .
.
цис-изомер транс-изомер
(оранжевый) (желтый)
В первом случае молекулы аммиака расположены по одну сторону от комплексообразователя, во втором - по разные стороны.
При увеличении числа неодинаковых лигандов быстро растет число геометрических изомеров.
Геометрические изомеры отличаются реакционной способностью, растворимостью и окраской.
Оптическая изомерия заключается в том, что комплекс может существовать в двух формах (оптических изомерах), одна из которых является зеркальным отражением структуры другой формы, причем структуры этих форм не могут быть совмещены друг с другом в результате простых поворотов.
Например,
комплексный ион
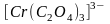 может существовать в виде двух оптических
изомеров:
может существовать в виде двух оптических
изомеров:
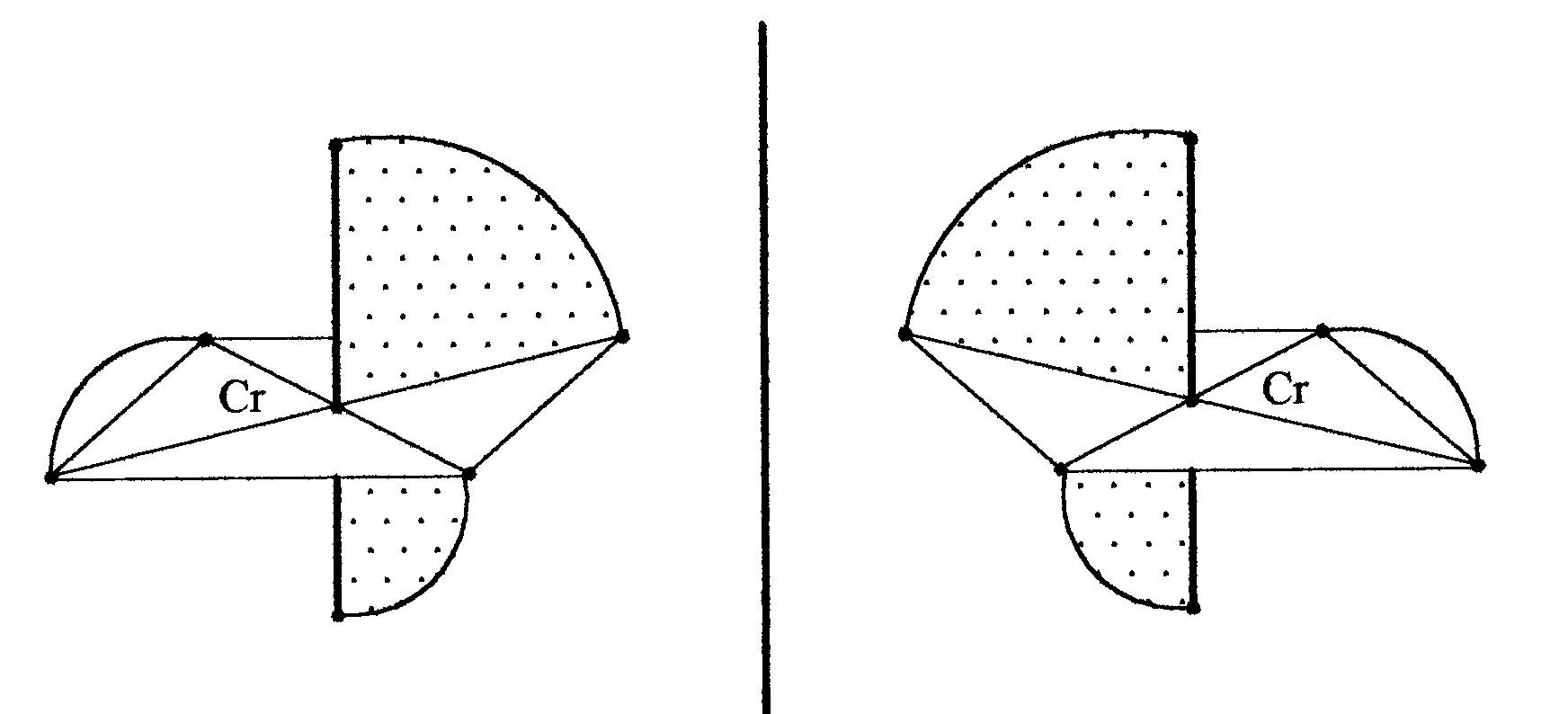
В структуре оптических изомеров отсутствует плоскость симметрии, и поэтому они обладают оптической активностью - вращают плоскость поляризации падающего на них света. Оба изомера вращают плоскость поляризации в равной мере, но в противоположных направлениях. Они имеют одинаковые химические и большую часть физических свойств. Поэтому разделение таких оптически активных изомеров требует особых методов.
Изучение пространственной структуры комплексных соединений позволило И.И.Черняеву в 1926 году открыть важнейшую закономерность, которой подчиняется реакционная способность этих соединений, получившая название «транс-влияние». Суть этой закономерности заключается в том, что неоднородные лиганды в транс-положении оказывают друг на друга влияние, обуславливающее их способность вступать в реакции замещения (обмена). Это явление имеет место в комплексных соединениях с квадратной или октаэдрической структурой.
Лиганды по силе своего трансвлияния можно расположить в следующий ряд:
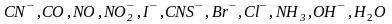 .
.
Слева направо активность лигандов падает.
Так, для комплексного иона
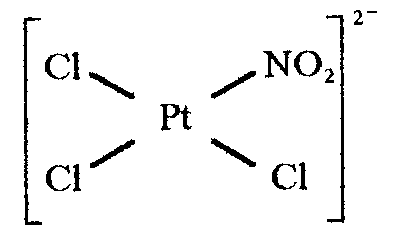
из трех ионов хлора легче других замещается тот, который находится в транс-положении к более транс-активному лиганду . Использование этой закономерности позволяет проводить направленный синтез веществ.
Сольватная
изомерия.
Причиной этого вида изомерии является
различное положение молекул растворителя
во внутренней или внешней сфере комплекса.
Если в роли растворителя выступает
вода, то говорят о гидратной
изомерии.
Типичным примером такого вида изомерии
является
 ,
существующий в трех разных формах:
,
существующий в трех разных формах:
;
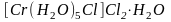 ;
;
(сине-фиолетовый) (светло-зеленый)
 .
.
(темно-зеленый)
Ионизационная изомерия. Она связана с неодинаковым распределением ионов между внешней и внутренней сферой комплексного соединения. Например:
 и
и
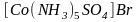 .
.
(красно-фиолетовый) (красный)
Координационная изомерия. Если комплексное соединение содержит одновременно два комплексообразователя, то возможно неодинаковое распределение лигандов между ними. Например:
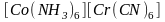 и
и
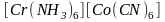 .
.
Изомерия связей. Некоторые монодентатные лиганды имеют в своем составе два атома, способных образовывать связи с комплексообразователем ( , , ). Например, координация лиганда возможна как через атом азота (нитро - комплексы):
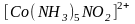 (желто-коричневый),
(желто-коричневый),
так и через атом кислорода (нитрито-комплексы):
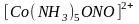 (розовый).
(розовый).
Такие лиганды называют амбидентатными.
Изомерия комплексных соединений не исчерпывается рассмотренными выше видами. Существуют еще и другие, более сложные виды изомерии.
