
- •Лекция 14.Комплексные соединения
- •1.Понятие о комплексном соединении
- •2.Структура комплексных соединений
- •3.Номенклатура комплексных соединений
- •4.Классификация комплексных соединений
- •4.1.Комплексные соединения, содержащие
- •4.2.Комплексные соединения, содержащие ионные лиганды
- •4.3. Циклические комплексные соединения
- •4.4. Многоядерные комплексные соединения
- •5.Изомерия комплексных соединений
- •6.Равновесия в растворах комплексных соединений
- •7.Квантово-механические методы трактовки химической связи в комплексных соединениях
- •7.1. Метод валентных связей
- •7.2. Теория кристаллического поля
- •8.Способность элементов периодической системы к комплексообразованию
- •9. Применение комплексных соединений
6.Равновесия в растворах комплексных соединений
Поведение комплексных соединений в водных растворах определяется прежде всего их устойчивостью. Комплексное соединение, имеющее внешнюю сферу, при растворении ведет себя как сильный электролит, диссоциируя на комплексный ион и внешнесферные ионы:
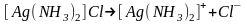 .
.
Такая диссоциация называется первичной.
Диссоциация
комплексных ионов (вторичная
диссоциация)
протекает ступенчато. Так, комплексный
ион
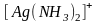 в водном растворе диссоциирует в две
стадии:
в водном растворе диссоциирует в две
стадии:
![]()
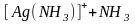 ;
(5.1)
;
(5.1)
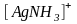
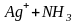 .
(5.2)
.
(5.2)
Эта запись является условной. В действительности происходит замещение лигандов, входящих во внутреннюю сферу комплексов молекулами растворителя:
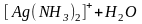
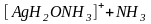 ;
;

 .
.
В уравнениях подобных реакций для простоты будем опускать
формулы воды и записывать их в упрощенном виде, как это сделано выше (5.1, 5.2).
Каждая стадия процесса характеризуется своей константой равновесия:
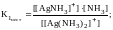
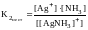 .
.
Константы равновесия в этом случае называют константами нестойкости. Они характеризуют устойчивость соответствующих комплексных ионов. Чем больше константа нестойкости, тем легче распадается комплексный ион на составные части (менее устойчив). Обычно каждый следующий лиганд отщепляется труднее, чем предыдущий. При перемножении всех констант ступенчатой диссоциации получаем общую константу нестойкости

характеризующую равновесие:
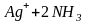 .
.
При оценке устойчивости комплексов часто для удобства пользуются не константами нестойкости, а показателями констант нестойкости, равными отрицательному десятичному логарифму Kнест
pK = -lgKнест.
Чем устойчивее комплексный ион, тем выше значение его рK.
Кроме константы нестойкости для количественной характеристики прочности комплексного иона пользуются также константой устойчивости Kуст.
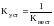 .
.
Константы устойчивости и нестойкости - взаимнообратные величины.
Общая константа устойчивости характеризует равновесие
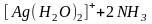
![]()
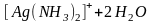 ,
,
или в упрощенном виде
.
Константа устойчивости характеризует тепловой и энтропийный эффекты процесса комплексообразования. Этот процесс в растворах, как и любая химическая реакция сопровождается уменьшением энергии Гиббса (G0). Так как G =-RTlnKуст, можно записать:
-RTlnKуст=H-TS.
Тепловой эффект комплексообразования (Н) обычно мал, так как замена связи комплексообразователя с сольватирующими молекулами растворителя на связь с лигандами не вызывает значительного перераспределения электронной плотности в системе и образования новых химических связей. S при комплексообразовании, как правило, значительно возрастает. Это связано в основном с ростом беспорядка в системе из-за освобождения при комплексообразовании молекул растворителя, сольватирующих комплексообразователь и лиганды.
Разрушение
комплексных соединений.
Комплексные соединения, находящиеся в
растворе, можно разрушить действием на
них других соединений или растворителя.
Это будет происходить, если в результате
этого действия образуются малорастворимые
соединения или новые комплексные ионы,
степень диссоциации которых меньше
степени диссоциации исходного комплексного
иона. Например, прибавление к раствору
сульфида калия приведет к полному
разрушению комплексной частицы и
осаждению иона серебра в виде
труднорастворимого осадка
 :
:
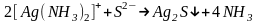 .
.
При образовании ионы серебра более полно удаляются из раствора, чем при образовании комплексного иона
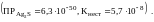
Разрушение
комплексного иона
будет также происходить, если к его
раствору прибавить KCN.
В этом случае ионы
с комплексообразователем образуют
более прочный комплексный ион
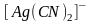 ,
общая константа нестойкости которого
равна 1,410-20:
,
общая константа нестойкости которого
равна 1,410-20:
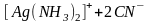
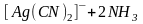 .
.
Комплексные соединения, относящиеся к группе малоустойчивых, могут быть разрушены при разбавлении их растворов, вследствие замены имеющихся лигандов на молекулы растворителя.
Кислотно-основные равновесия. Такие равновесия в растворах комплексных соединений вполне удовлетворительно описываются в рамках протолитической теории. С точки зрения кислотно-основных свойств представляют интерес равновесия в растворах амминокомплексов, гидроксокомплексов и аквакомплексов.
В растворах амминокомплексов происходит диссоциация координированных молекул аммиака по кислотному типу - с отщеплением протона, при этом амминокомплекс превращается в амидокомплекс:
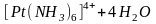

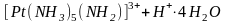 .
.
В
этой реакции
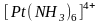 и
и
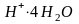 проявляют свойства кислоты, а
и
проявляют свойства кислоты, а
и
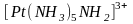 - основания. Обратим внимание на то, что
некоординированные молекулы аммиака
в растворе ведут себя как основания.
Таким образом, при координации происходит
существенное изменение свойств лигандов.
- основания. Обратим внимание на то, что
некоординированные молекулы аммиака
в растворе ведут себя как основания.
Таким образом, при координации происходит
существенное изменение свойств лигандов.
Гидроксокомплексы вступают в водных растворах в обратимые реакции внутрисферного замещения гидроксильных групп на молекулы воды:
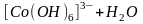
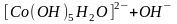 .
.
Таким образом, гидроксокомплексы являются основаниями.
В аквакомплексах в результате поляризационного действия комплексообразователя на лиганды усиливается диссоциация координированных молекул воды. При этом протоны выталкиваются из внутренней сферы аквакомплексов и образуются гидроксокомплексы, а раствор приобретает кислотные свойства. Например:
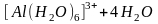
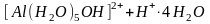 .
.
Напомним, что по такой схеме происходит гидролиз солей хрома, алюминия и других металлов, дающих малодиссоциирующие гидроксиды.
В заключение отметим: кислотно-основные свойства комплексов зависят от размера, заряда и поляризационных свойств комплексообразователя, от величины заряда комплексного иона, степени диссоциации молекул RН (лигандов) в свободном состоянии, от устойчивости комплекса в растворе, от его строения и характера взаимного влияния координированных групп.
