
- •Лекция 14.Комплексные соединения
- •1.Понятие о комплексном соединении
- •2.Структура комплексных соединений
- •3.Номенклатура комплексных соединений
- •4.Классификация комплексных соединений
- •4.1.Комплексные соединения, содержащие
- •4.2.Комплексные соединения, содержащие ионные лиганды
- •4.3. Циклические комплексные соединения
- •4.4. Многоядерные комплексные соединения
- •5.Изомерия комплексных соединений
- •6.Равновесия в растворах комплексных соединений
- •7.Квантово-механические методы трактовки химической связи в комплексных соединениях
- •7.1. Метод валентных связей
- •7.2. Теория кристаллического поля
- •8.Способность элементов периодической системы к комплексообразованию
- •9. Применение комплексных соединений
7.Квантово-механические методы трактовки химической связи в комплексных соединениях
Для описания химической связи в комплексных соединениях используются различные квантово-механические методы. В их числе уже ранее использованные нами для описания неорганических соединений первого порядка методы валентных связей (МВС) и молекулярных орбиталей (ММО). Кроме того, существует теория, разработанная специально для описания химической связи в комплексах - теория кристаллического поля (ТКП). Здесь мы остановимся на применении метода валентных связей и теории кристаллического поля к объяснению связи в комплексных соединениях.
7.1. Метод валентных связей
Метод валентных связей предполагает, что координационные связи между комплексообразователем и лигандами ковалентные и образуются по донорно-акцепторному механизму. Химическая связь возникает как результат перекрывания валентных вакантных атомных орбиталей комплексообразователя с заполненными орбиталями донора-лиганда. Чем больше степень перекрывания орбиталей комплексообразователя и лигандов, тем прочнее связь. При этом разные исходные орбитали комплексообразователя подвергаются гибридизации и превра-
щаются в новый набор эквивалентных орбиталей, с определенными пространственными свойствами. Строение и прочность комплексного соединения зависят от характера орбиталей, участвующих в гибридизации. Так, если в образовании связи участвуют две d-, одна s- и три р-орбитали (d2sp3 или sp3d2 гибридизация), то комплекс имеет октаэдрическое строение. Если имеет место sp3 или sd3 гибридизация, то комплексное соединение имеет тетраэдрическое строение, dsp2- гибридизация приводит к образованию комплексного соединения, имеющего структуру плоского квадрата.
Напомним, что метод ВС рассматривает образование только -связей. Ниже приведем несколько примеров.
Вначале рассмотрим механизм образования комплексного иона .
Ион-комплексообразователь
 получается в результате
получается в результате
отщепления от атома Ag(5s14d105p0) одного 5s-электрона. В катионе на внешнем энергетическом уровне имеются незаполненные орбитали на 5s-, 5р-подуровнях и поэтому он может играть роль акцептора электронных пар:
![]()
![]() В
молекуле
,
как мы уже знаем, атом азота имеет
неподеленную электронную пару (2s2)
и, следовательно, молекулы аммиака могут
быть донорами электронных пар. При
взаимодействии катиона
с молекулами аммиака происходит
гибридизация его орбиталей (5s-
и двух 5р-орбиталей). В результате
получаются две одинаковые по форме
sp-гибридные
орбитали, которые перекрываются с
орбиталями двух молекул-лигандов. Это
приводит к образованию двух
связей.
В
молекуле
,
как мы уже знаем, атом азота имеет
неподеленную электронную пару (2s2)
и, следовательно, молекулы аммиака могут
быть донорами электронных пар. При
взаимодействии катиона
с молекулами аммиака происходит
гибридизация его орбиталей (5s-
и двух 5р-орбиталей). В результате
получаются две одинаковые по форме
sp-гибридные
орбитали, которые перекрываются с
орбиталями двух молекул-лигандов. Это
приводит к образованию двух
связей.
![]()
Комплексный ион имеет линейную структуру, которая обусловлена взаимной ориентацией в пространстве двух sp-гибридных орбиталей, занятых электронными парами связей, образованных по донорно-акцепторному механизму.
Свойства
комплексных соединений зависят от
степени перекрывания орбиталей
комплексообразователя и лигандов.
Рассмотрим это на примере двух комплексных
частиц
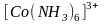 и
и
 .
.
В
данных комплексных ионах комплексообразователем
является ион
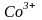 ,
имеющий следующее строение внешних
энергетических уровней:
,
имеющий следующее строение внешних
энергетических уровней:
![]() .
.
В случае лигандами являются молекулы NH3, создающие сильное электростатическое поле, при действии которого происходит предварительное спаривание 3d-электронов комплексообразователя. При этом освобождаются две 3d-орбитали, которые участвуют в гибридизации. Образовавшиеся шесть гибридных 3d24s4p3-орбиталей перекрываются с орбиталями шести лигандов
![]() .
.
Получающийся при этом комплекс называется низкоспиновым, или внутриорбитальным. Он не имеет магнитного момента, так как содержит только спаренные электроны.
Ионы
,
являющиеся лигандами в комплексе
 ,
имеют слабое электростатическое поле.
Они поставляют электронные пары на
вакантные орбитали комплексообразователя
(4s,
4p,
4d),
а 3d-орбитали,
содержащие по одному электрону
сохраняются. При этом осуществляется
4s4p34d2-гибридизация:
,
имеют слабое электростатическое поле.
Они поставляют электронные пары на
вакантные орбитали комплексообразователя
(4s,
4p,
4d),
а 3d-орбитали,
содержащие по одному электрону
сохраняются. При этом осуществляется
4s4p34d2-гибридизация:
![]() .
.
Образовавшийся комплекс является высокоспиновым или внешнеорбитальными, имеет магнитный момент, величина которого определяется числом неспаренных электронов.
Метод валентных связей является наглядным методом, предсказывающим геометрическое строение комплексов, число неспаренных электронов и, следовательно, магнитные свойства. Однако этот метод не позволяет описывать прочность и оптические свойства комплексов. Более эффективной в этом отношении является теория кристаллического поля.
