
- •Лекция 14.Комплексные соединения
- •1.Понятие о комплексном соединении
- •2.Структура комплексных соединений
- •3.Номенклатура комплексных соединений
- •4.Классификация комплексных соединений
- •4.1.Комплексные соединения, содержащие
- •4.2.Комплексные соединения, содержащие ионные лиганды
- •4.3. Циклические комплексные соединения
- •4.4. Многоядерные комплексные соединения
- •5.Изомерия комплексных соединений
- •6.Равновесия в растворах комплексных соединений
- •7.Квантово-механические методы трактовки химической связи в комплексных соединениях
- •7.1. Метод валентных связей
- •7.2. Теория кристаллического поля
- •8.Способность элементов периодической системы к комплексообразованию
- •9. Применение комплексных соединений
Лекция 14.Комплексные соединения
К классу комплексных соединений (комплексов) относится огромное число веществ. Их известно значительно больше, чем всех других неорганических веществ. Они играют важную роль в живой природе и различных технологических процессах.
В качестве примера можно привести гемоглобин (комплексное соединение железа), благодаря которому осуществляется перенос кислорода из легких к клеткам тканей; хлорофилл (комплексное соединение магния) - обеспечивающий фотосинтез в растениях.
В промышленности комплексные соединения широко применяются как катализаторы при производстве кислот и химической переработке нефти, для извлечения металлов из руд, получения лаков, красок, фотоматериалов, консервирования пищи.
Сейчас химия комплексных соединений является одной из наиболее быстро развивающихся областей химии. Ежегодно в лабораториях синтезируются и исследуются тысячи новых комплексных соединений. Уже сегодня химики могут осуществлять направленный синтез комплексных соединений с заданными свойствами.
1.Понятие о комплексном соединении
История
развития химии комплексных («complex»
- сложный) соединений насчитывает более
150 лет. Давно было доказано, что молекулы
многих веществ, способных к самостоятельному
существованию, могут взаимодействовать
и образовывать новые более сложные
молекулы. Например, сульфат меди (II)
и аммиак могут существовать раздельно.
Однако при пропускании через водный
раствор сульфата меди (II)
газообразного аммиака они взаимодействуют
и образуется новое комплексное соединение
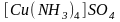 :
:
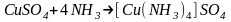 .
.
В
растворе этого соединения не обнаруживается
исходный гидратированный ион
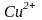 .
Полученное комплексное соединение
характеризуется собственными физическими
и химическими свойствами, отличными от
свойств исходных веществ.
.
Полученное комплексное соединение
характеризуется собственными физическими
и химическими свойствами, отличными от
свойств исходных веществ.
Исходные
соединения в этом взаимодействии
называют соединениями
первого порядка.
К ним относятся, главным образом, бинарные
и некоторые другие достаточно простые
по своей структуре соединения (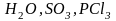 и т.д.). В этих соединениях абсолютные
значения степеней окисления элементов
совпадают с проявляемыми ими валентностями.
и т.д.). В этих соединениях абсолютные
значения степеней окисления элементов
совпадают с проявляемыми ими валентностями.
Соединения, получающиеся в результате взаимодействия соединений первого порядка, называются соединениями высшего порядка. К их числу относятся и комплексные соединения. В комплексных соединениях элементы проявляют дополнительные валентности.
Поскольку комплексные соединения весьма многочисленны и разнообразны, дать общее исчерпывающее определение невозможно. Однако, учитывая выше сказанное, можно считать, что комплексные соединения - это сложные вещества, в которых валентность (число химических связей) центрального атома больше абсолютного значения его степени окисления. Например, - комплексное соединение, так как валентность атома меди в нем равно 4, а степень окисления +2.
2.Структура комплексных соединений
Первой теорией, позволившей объяснить образование комплексных соединений, была координационная теория, предложенная в 1893 году швейцарским ученым Альфредом Вернером. Эта теория дала возможность установить строение комплексных соединений задолго до разработки физических методов определения структуры веществ.
Согласно
теории Вернера, в молекуле комплексного
соединения центральное место занимает
комплексообразователь
(заряженный
или нейтральный атом). Типичными
комплексообразователями являются ионы
и атомы переходных металлов, в частности,
хорошие комплексообразователи - ионы
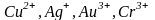 ,
атомы элементов VIII
В группы периодической системы.
,
атомы элементов VIII
В группы периодической системы.
Вокруг комплексообразователя расположены ( координированы ) лиганды (от лат. ligar - связывать) - атомы, молекулы или ионы противоположного знака. Молекулы и ионы могут быть простыми или сложными.
Число
химических связей, устанавливаемых
комплексообразователем с лигандами,
называется координационным
числом
(к.ч.) комплексообразователя. Оно может
принимать различные значения. Например,
у меди в комплексе
к.ч.=4, у алюминия в
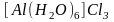 к.ч.=6. Координационные числа имеют
значения от 2 до 12, но чаще всего они
равны 4 или 6. Величина к.ч., как правило
(но не всегда!), в два раза больше степени
окисления комплексообразователя.
Некоторые лиганды содержат несколько
функциональных групп, которые могут
образовывать химические связи с
комплексообразователем. Подобные
лиганды занимают в комплексе координационные
места нескольких обычных лигандов.
Число химических связей, образуемых
лигандом с комплексообразователем,
определяет координационную
емкость (дентатность)
лиганда. Так,
к.ч.=6. Координационные числа имеют
значения от 2 до 12, но чаще всего они
равны 4 или 6. Величина к.ч., как правило
(но не всегда!), в два раза больше степени
окисления комплексообразователя.
Некоторые лиганды содержат несколько
функциональных групп, которые могут
образовывать химические связи с
комплексообразователем. Подобные
лиганды занимают в комплексе координационные
места нескольких обычных лигандов.
Число химических связей, образуемых
лигандом с комплексообразователем,
определяет координационную
емкость (дентатность)
лиганда. Так,
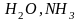 имеют координационную емкость
(дентатность) равную единице, а
NH2CH2CH2NH2
(этилендиамин) - двум. Известны лиганды
с координационной емкостью, равной
трем, четырем и более единицам.
имеют координационную емкость
(дентатность) равную единице, а
NH2CH2CH2NH2
(этилендиамин) - двум. Известны лиганды
с координационной емкостью, равной
трем, четырем и более единицам.
Комплексообразователь и лиганды вместе образуют внутреннюю координационную сферу комплексного соединения - комплексную частицу (ион или молекулу).
Если
внутренняя сфера заряжена, то комплекс
имеет еще и внешнюю
сферу,
поскольку к внутренней сфере будут
притягиваться противоположно заряженные
ионы. Принято в формулах комплексных
соединений внутреннюю сферу отделять
от внешней квадратными скобками. Так,
в комплексном соединении
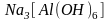 ион
ион
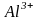 - комплексообразователь, ионы
- комплексообразователь, ионы
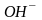 - лиганды, координационное число равно
6,
- лиганды, координационное число равно
6,
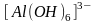 - внутренняя сфера, ионы
- внутренняя сфера, ионы
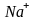 - внешняя
сфера.
- внешняя
сфера.
