
- •5. Основы химической кинетики
- •1) Скорость гомогенных реакций
- •1.1)Закон действующих масс (з.Д.М.)
- •1.2) Молекулярность и порядок реакции
- •1.3) Интегрирование дифференциальных кинетических уравнений
- •1.4) Классификация реакций по степени сложности
- •1.5) Зависимость скорости реакции от температуры.
- •1.6) Принцип а. Ле-Шателье
- •2) Скорость гетерогенных реакций
- •2.1) Скорость растворение твердого тела в жидкости
- •3) Гомогенный и гетерогенный катализ
- •6. Растворы
- •1) Способы выражения концентрации растворов
- •2) Физические и химические процессы при растворении.
- •3.4) Закон распределения и коэффициент распределения
- •4) Законы ф.-м. Рауля. Эбулиоскопия и криоскопия
- •5) Растворы электролитов
- •5.1) Электролитическая диссоциация
- •5.2) Сильные и слабые электролиты. Степень диссоциации и константа диссоциации. Закон разведения Оствальда.
- •7) Гидролиз солей. Константа и степень гидролиза
- •10. Поверхностные явления
- •1) Адгезия, когезия, сорбция: адсорбция и абсорбция. Физическая адсорбция. Хемосорбция. Величина адсорбции
- •2) Механизм адсорбции
- •3) Термодинамика поверхностных явления
- •3.1) Поверхностное натяжение твёрдых тел. Принцип Гиббса-Кюри
- •3.2) Поверхностное натяжение растворов
- •4) Изотерма адсорбции Лэнгмюра, эмпирическое уравнение Фрейндлиха.
- •8. Основы электрохимии
- •1) Электродные потенциалы. Возникновение скачка потенциала на поверхности раздела "металл-раствор". Равновесны потенциал.
- •2) Теория гальванического элемента
- •2.1) Медно-цинковый элемент Якоби-Даниэля
- •2.2) Термодинамика гальванического элемента
- •3) Водородный показатель. Понятие о стандартных потенциалах. Ряд напряжений
- •4) Типы электродов и цепей
- •4.1) Окислительно-восстановительные электроды и цепи
- •5) Электролиз
- •5.1) Общие положения
- •5.2) Последовательность разряда ионов в водных растворах
- •5.3) Количественные законы электролиза (законы м. Фарадея). Удельный расход энергии
- •5.4) Поляризация. Напряжение разложения и перенапряжение
- •5.5) Практические приложение электролиза
- •6) Химические источники тока (хит)
- •6.1) Общие положения
- •6.2) Первичный хит - гальванические элементы
- •6.3) Вторичные хит-аккумуляторы
- •6.4) Топливные элементы
- •9. Коррозия металлов и методы борьбы с ней
- •1) Классификация процессов коррозии
- •2) Химическая коррозия (газовая и жидкостная)
- •3) Гальванокоррозия (микро- и макро)
- •4) Электрокоррозия
- •5) Атмосферная и почвенная коррозия
- •6) Методы борьбы с коррозией
3) Водородный показатель. Понятие о стандартных потенциалах. Ряд напряжений
Опытным путём можно определить разность потенциалов между электродом и эталонным электродом, потенциал которого условно считают равным нулю. В качестве такого электрода принят нормальный водородный электрод.
Таким образом, за условную величину, характеризующую потенциал данного электрода, принимают ЭДС гальванического элемента, составленного из этого электрода и нормального водородного электрода.
Рассмотрим гальваническую цепь, составленную из цинкового электрода и н.в.э.:
Активность
ионов цинка
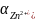 ,
активность водорода
,
активность водорода
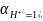 .
.
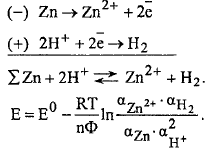 Процессы в элементе:
Процессы в элементе:
Активность
металлического цинка равна 1, а активность
газообразного водорода также равна 1,
так как взят н.в.э. Цинк заряжается
отрицательно по отношению к н.в.э.,
следовательно, электродный потенциал
цинка равен ЭДС цинково-водородного
элемента с обратным знаком:
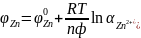 ,
где
,
где
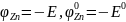 ,
знак перед сомножителем логарифма
изменён с "минуса" на "плюс".
,
знак перед сомножителем логарифма
изменён с "минуса" на "плюс".
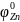 - электродный потенциал цинка при
активности ионов его в растворе
- электродный потенциал цинка при
активности ионов его в растворе
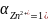 ,
это - нормальный потенциал цинка.
,
это - нормальный потенциал цинка.
Отрицательный потенциал принадлежит тем электродам, которые заряжаются отрицательной по отношению к н.в.э. На этих электродах при работе элемента в паре с н.в.э ионы металлов переходят с электрода в раствор.
Положительный потенциал означает, что по отношению к н.в.э. данный электрод заряжается положительно и при работе соответствующего элемента ионы металла переходят из раствора на электрод.
4) Типы электродов и цепей
Различают три разновидности так называемых химических электродов. Это электроды первого, второго и третьего рода.
Электроды
первого рода - металлы, погруженные
в растворы своих солей:
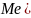
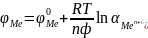 ,
т.е. потенциалопределяющими ионами
являются катионы металлов.
,
т.е. потенциалопределяющими ионами
являются катионы металлов.
Электроды
второго рода - металл погружен в
насыщенный раствор своей малорастворимой
соли, к которой добавлена другая соль
с тем же анионом, но хорошо растворимая,
например,
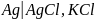 .
.
Процессы на электроде:
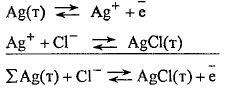
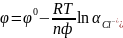 ,
т.е. потенциалопределяющими ионами
являются анионы
,
т.е. потенциалопределяющими ионами
являются анионы
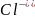 .
Знак "минус" в формуле для
.
Знак "минус" в формуле для
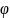 использован потому, что получение аниона
есть результат протекания процесса
восстановления.
использован потому, что получение аниона
есть результат протекания процесса
восстановления.
Электроды третьего рода (газовые электроды).
Известные водородный, кислородный и хлорный электроды.
Для водородного
электрода
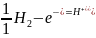 ,
,
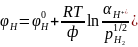 , т.е. потенциал газового электрода
зависит как от активности ионов в
растворе, так и от парциального давления
газа.
, т.е. потенциал газового электрода
зависит как от активности ионов в
растворе, так и от парциального давления
газа.
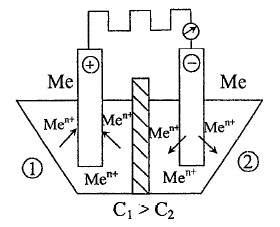
Концентрационная цепь.
В
керамический сосуд, разделеённый
полупроницаемой перегородкой на два
отделения 1 и 2, помещены два одинаковых
металлических электрода и залиты
растворы, содержащие ионы
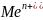 ,
но в различной концентрации.
,
но в различной концентрации.
 В
отделении 1:
В
отделении 1:
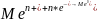 ,
в отделении 2:
,
в отделении 2:
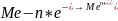 ,
т.е. в левом отделении концентрация
,
т.е. в левом отделении концентрация
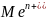 уменьшается за счёт протекания процесса
восстановления, это - положительный
электрод; в правом отделении концентрация
увеличивается за счёт протекания
процесса окисления, это отрицательный
электрод. ЭДС элемента:
уменьшается за счёт протекания процесса
восстановления, это - положительный
электрод; в правом отделении концентрация
увеличивается за счёт протекания
процесса окисления, это отрицательный
электрод. ЭДС элемента:
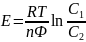 .
.
Амальгамные электроды и цепи.
Амальгама - сплав металла со ртутью, остающийся жидким при комнатной температуре.
При работе
элемента в отделении 1 протекает процесс
окисления:
 ,
т.е. электрод имеет знак "минус", в
отделении 2 - процесс восстановления:
,
т.е. электрод имеет знак "минус", в
отделении 2 - процесс восстановления:
 ,
электрод имеет знак "плюс". ЭДС
элемента:
,
электрод имеет знак "плюс". ЭДС
элемента:
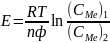 .
.
