
- •5. Основы химической кинетики
- •1) Скорость гомогенных реакций
- •1.1)Закон действующих масс (з.Д.М.)
- •1.2) Молекулярность и порядок реакции
- •1.3) Интегрирование дифференциальных кинетических уравнений
- •1.4) Классификация реакций по степени сложности
- •1.5) Зависимость скорости реакции от температуры.
- •1.6) Принцип а. Ле-Шателье
- •2) Скорость гетерогенных реакций
- •2.1) Скорость растворение твердого тела в жидкости
- •3) Гомогенный и гетерогенный катализ
- •6. Растворы
- •1) Способы выражения концентрации растворов
- •2) Физические и химические процессы при растворении.
- •3.4) Закон распределения и коэффициент распределения
- •4) Законы ф.-м. Рауля. Эбулиоскопия и криоскопия
- •5) Растворы электролитов
- •5.1) Электролитическая диссоциация
- •5.2) Сильные и слабые электролиты. Степень диссоциации и константа диссоциации. Закон разведения Оствальда.
- •7) Гидролиз солей. Константа и степень гидролиза
- •10. Поверхностные явления
- •1) Адгезия, когезия, сорбция: адсорбция и абсорбция. Физическая адсорбция. Хемосорбция. Величина адсорбции
- •2) Механизм адсорбции
- •3) Термодинамика поверхностных явления
- •3.1) Поверхностное натяжение твёрдых тел. Принцип Гиббса-Кюри
- •3.2) Поверхностное натяжение растворов
- •4) Изотерма адсорбции Лэнгмюра, эмпирическое уравнение Фрейндлиха.
- •8. Основы электрохимии
- •1) Электродные потенциалы. Возникновение скачка потенциала на поверхности раздела "металл-раствор". Равновесны потенциал.
- •2) Теория гальванического элемента
- •2.1) Медно-цинковый элемент Якоби-Даниэля
- •2.2) Термодинамика гальванического элемента
- •3) Водородный показатель. Понятие о стандартных потенциалах. Ряд напряжений
- •4) Типы электродов и цепей
- •4.1) Окислительно-восстановительные электроды и цепи
- •5) Электролиз
- •5.1) Общие положения
- •5.2) Последовательность разряда ионов в водных растворах
- •5.3) Количественные законы электролиза (законы м. Фарадея). Удельный расход энергии
- •5.4) Поляризация. Напряжение разложения и перенапряжение
- •5.5) Практические приложение электролиза
- •6) Химические источники тока (хит)
- •6.1) Общие положения
- •6.2) Первичный хит - гальванические элементы
- •6.3) Вторичные хит-аккумуляторы
- •6.4) Топливные элементы
- •9. Коррозия металлов и методы борьбы с ней
- •1) Классификация процессов коррозии
- •2) Химическая коррозия (газовая и жидкостная)
- •3) Гальванокоррозия (микро- и макро)
- •4) Электрокоррозия
- •5) Атмосферная и почвенная коррозия
- •6) Методы борьбы с коррозией
3) Гальванокоррозия (микро- и макро)
Рассмотрим механизм микро-гальванокоррозии на примерс растворе- ния химически-чистого железа в разбавленной серной кислоте.
На границе «металл-жидкость» образуется слой ионов Fe2+, удерживаемых отрицательно заряженным металлом у своей поверхности (отрицательный заряд создается электронами после перехода ионов Fe в раствор). Ионы железа удерживают на определенном расстоянии ионы Н+, не давая им восстановиться за счет электронов железа. Отсюда и коррозионная стойкость химически чистого железа.
Техническое железо содержит вкрапления углерода, который не передает в раствор положительных ионов и не имеет, следовательно, заградительного барьера от ионов Н+. Возникает коррозионный коротко-замкнутый гальванический элемент, в котором роль «плюса» играет углерод, на котором идет восстановление ионов Н+, а роль «минуса» - участки по периферии углерода, на которых идет растворение железа. Электроны идут от железа к углероду, а в электролите возникает поток положительных зарядов - от железа к углероду.
Гальваническая цепь: , процессы:
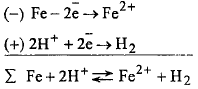 В
техническом железе образуется множество
короткозамкнутых элементов, разбросанных
по всей поверхности металла. Работа
этих микро-элементов, суммируясь, дает
макроэффект растворения металла в
кислоте.
В
техническом железе образуется множество
короткозамкнутых элементов, разбросанных
по всей поверхности металла. Работа
этих микро-элементов, суммируясь, дает
макроэффект растворения металла в
кислоте.
«Минус» коротко-замкнутого элемента - это менее благородный металл (по ряду напряжений), «плюс» - более благородный.
Гальванокоррозия может протекать водородной или кислородной деполяризацией. В первом случае приток электронов от «минуса» к «плюсу» поляризует последний, а ионы Н+, связывая электроны, тем самым деполяризуют «плюс». Коррозия технического железа, рассмотренная выше, протекала с водородной деполяризацией. Еще пример: .
Водородная деполяризация имеет место в растворах кислот с достаточно большой концентрацией Н+ и даже - в нейтральной среде, если сами металлы очень активны (К, Na, Mg).
Во втором случае (с кислородной деполяризаций) роль окислителя, связывающего электроны на «плюсе», играет растворенный молекулярный кислород. Этот процесс протекает в тех случаях, когда активность металлов невелика или же растворы близки к нейтральным - не слишком кислые.
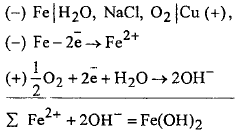
Возможна и
смешанная деполяризация, в которой
принимают участие и О2, и Н+.
Наконец, в процессе деполяризации могут
участвовать и другие окислители,
например, ионы
 .
.
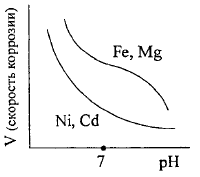
На процесс электрохимической коррозии оказывают влияние рH и температура. Температура ускоряет коррозию, поскольку увеличивается скорость реакции и быстрее растворяются продукты коррозии. Влияние рH коррозионной среды на различные металлы значительно различается.
При малых рН (высокая концентрация Н+) повышается электропроводимость, что ускоряет электрохимические процессы, хорошо растворяются продукты коррозии. При малых и высоких pH уве- личивается скорость коррозии амфотерных металлов.
 Алюминий
рeагирует с водой, давая
пленку Al(ОН)3 :
Алюминий
рeагирует с водой, давая
пленку Al(ОН)3 :
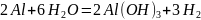
Эта пленка нерастворима в воде, при pH=7 скорость коррозии минимальна.
Макрогальванокоррозия. В основе процесса лежит макроэлемент — коррозионный элемент, электроды которого имеют размеры, хорошо различимые невооруженным глазом.
Коррозионные макроэлементы возникают во всех случаях, когда в той или иной конструкции в присутствии электролита соприкасаются металлы, сильно различающиеся по своему положению в ряду напряжений.
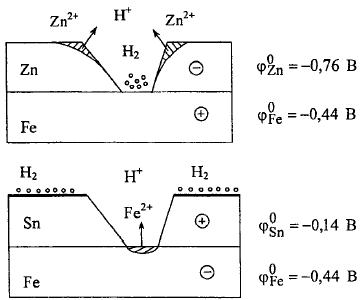 Цинковое
покрытие на железе нарушено в кислой
среде. Возникает коррозионный элемент,
в котором «минусом» является цинк как
менее благородный металл, «плюсом» -
железо.
Цинковое
покрытие на железе нарушено в кислой
среде. Возникает коррозионный элемент,
в котором «минусом» является цинк как
менее благородный металл, «плюсом» -
железо.
Процессы:
Покрытие из менее благородного металла носит название «анодного», оно электрохимически разрушается при нарушении его целостности.
Оловянное покрытие при нарушении его целостности является «плюсом» макроэлемента, процессы в кислой среде:
Покрытие из более благородного металла (по ряду напряжений) носит название «катодного», при нарушении его целостности электрохимически разрушастся защищасмый металл.
Процесс макрогальанокоррозии, помимо контакта двух металлов, может ппротекать и при неравномерной аэрации различных участков поверхностиодного и того же металла.
