
- •5. Основы химической кинетики
- •1) Скорость гомогенных реакций
- •1.1)Закон действующих масс (з.Д.М.)
- •1.2) Молекулярность и порядок реакции
- •1.3) Интегрирование дифференциальных кинетических уравнений
- •1.4) Классификация реакций по степени сложности
- •1.5) Зависимость скорости реакции от температуры.
- •1.6) Принцип а. Ле-Шателье
- •2) Скорость гетерогенных реакций
- •2.1) Скорость растворение твердого тела в жидкости
- •3) Гомогенный и гетерогенный катализ
- •6. Растворы
- •1) Способы выражения концентрации растворов
- •2) Физические и химические процессы при растворении.
- •3.4) Закон распределения и коэффициент распределения
- •4) Законы ф.-м. Рауля. Эбулиоскопия и криоскопия
- •5) Растворы электролитов
- •5.1) Электролитическая диссоциация
- •5.2) Сильные и слабые электролиты. Степень диссоциации и константа диссоциации. Закон разведения Оствальда.
- •7) Гидролиз солей. Константа и степень гидролиза
- •10. Поверхностные явления
- •1) Адгезия, когезия, сорбция: адсорбция и абсорбция. Физическая адсорбция. Хемосорбция. Величина адсорбции
- •2) Механизм адсорбции
- •3) Термодинамика поверхностных явления
- •3.1) Поверхностное натяжение твёрдых тел. Принцип Гиббса-Кюри
- •3.2) Поверхностное натяжение растворов
- •4) Изотерма адсорбции Лэнгмюра, эмпирическое уравнение Фрейндлиха.
- •8. Основы электрохимии
- •1) Электродные потенциалы. Возникновение скачка потенциала на поверхности раздела "металл-раствор". Равновесны потенциал.
- •2) Теория гальванического элемента
- •2.1) Медно-цинковый элемент Якоби-Даниэля
- •2.2) Термодинамика гальванического элемента
- •3) Водородный показатель. Понятие о стандартных потенциалах. Ряд напряжений
- •4) Типы электродов и цепей
- •4.1) Окислительно-восстановительные электроды и цепи
- •5) Электролиз
- •5.1) Общие положения
- •5.2) Последовательность разряда ионов в водных растворах
- •5.3) Количественные законы электролиза (законы м. Фарадея). Удельный расход энергии
- •5.4) Поляризация. Напряжение разложения и перенапряжение
- •5.5) Практические приложение электролиза
- •6) Химические источники тока (хит)
- •6.1) Общие положения
- •6.2) Первичный хит - гальванические элементы
- •6.3) Вторичные хит-аккумуляторы
- •6.4) Топливные элементы
- •9. Коррозия металлов и методы борьбы с ней
- •1) Классификация процессов коррозии
- •2) Химическая коррозия (газовая и жидкостная)
- •3) Гальванокоррозия (микро- и макро)
- •4) Электрокоррозия
- •5) Атмосферная и почвенная коррозия
- •6) Методы борьбы с коррозией
6. Растворы
Раствор - гомогенная система, в которой одно вещество равномерно распределено в среде другого вещества (или веществ).
Разбавленные растворы: содержание одного компонента мало по сравнению с содержанием другого.
Концентрированные растворы: в них относительные количество растворенного вещества и растворителя одного порядка.
Насыщенный раствор: взятое вещество в нём при заданной температуре более не растворяется даже при продолжительном перемешивании.
Концентрация насыщенного раствора - это мера растворимости вещества при данных условиях.
Перенасыщенный раствор: содержание растворённого вещества в нём значительно превышает предел насыщения.
1) Способы выражения концентрации растворов
Молярные доли (дроби) показывают, какую долю составляет число молей данного компонента от общего числа молей всех компонентов раствора.
Процентное выражение концентрации:
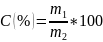
Концентрация, выражаемая через плотность раствора.
Молярная концентрация (СМ) показывает, сколько молей растворённого вещества содержится в 1 л раствора:
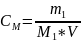
Молялная концентрация (Сm) показывает, сколько молей растворённого вещества находится на 1000 г растворителя:
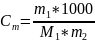
Нормальная концентрация (СН) показывает, сколько грамм-эквивалентов растворённого вещества содержится в 1 л раствора.
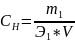
Титр - это числа граммов растворённого вещества в 1 мл раствора.
2) Физические и химические процессы при растворении.
Одномерность раствора, выделение или поглощение теплоты при растворении, а также изменение объёма позволяют считать раствор химическим соединением растворителя и растворённого вещества.
Изменение состава раствора в очень широких пределах, а также возможность обнаружения в свойствах раствора свойств отдельных слагающих его компонентов делает возможным отнесение раствора к механической смеси.
Физическая теория растворов рассматривает растворитель как некоторую индифферентную среду, в которой равномерно размешиваются молекулы растворённого вещества по всему объёму раствора. Межмолекулярное взаимодействие как между частицами растворённого вещества, так и между ними и молекулами растворителя, отсутствуют. Растворы рассматриваются как молекулярные смеси.
Согласно химической теории растворов, растворитель даёт с растворённым веществом определённые химические соединения - сольваты. Молекулы сольватов (гидратов) образуют с растворителем молекулярную смесь.
Сольваты - менее прочные, нежели обычные химические соединения, они легко разрушаются даже при небольшом повышении температуры растворов.
Количество теплоты, поглощаемой (или выделяемой) при растворении одного моля вещества, называют теплотой растворения этого вещества.
3) Растворимость твёрдых веществ в жидкостях, жидкостей в жидкостях и газов в жидкостях
3.1) Растворимость твёрдых веществ в жидкостях
Для идеальных растворов справедливо уравнение Шредера:
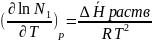
Идеальная растворимость твёрдого вещества увеличивается с повышением температуры.
Давление мало влияет на растворимость твёрдых тел в жидкостях.
3.2) Растворимость жидкостей в жидкостях.
Существует неорганическая растворимость - жидкости смешиваются друг с другом в любый пропорциях и растворимость до известного предела, когда имеет место расслаивание.
Качественная закономерность гласит: "полярное обычно растворимо в полярном, неполярное - в неполярном".
3.3) Растворимость газов в жидкостях. Закон В.Генри. Закон Д.Дальтона
Растворимость газов с повышением температуры уменьшается.
Согласно закону Генри, растворимость газа, выраженная в весовых единицах, при постоянной температуре пропорциональна давлению газа над раствором.
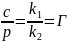
где Г- константа Генри.
Закону Генри строго подчиняются те газы, растворимость которых невелика и которые не вступают в химическое взаимодействие с растворителем, т.е. мы имеем дело с идеальным раствором, в котором молекулы растворённого вещества разделены друг от друга большим числом молекул растворителя.
В разбавленного растворе все выражения для концентрации пропорциональны друг другу, то закон Генри справедлив при любом способе выражения концентрации.
Для некоторых
газов справедлив закон Сивертса
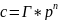 ,
где "n" уменьшается
с ростом температуры.
,
где "n" уменьшается
с ростом температуры.
Объём газа, растворяющегося в данном объёме жидкости, не зависит от давления.
Закон Джона Дальтона: в случае растворения смеси газов в жидкости каждый их них растворяется пропорционально своему парциальному давлению.
