
- •5. Основы химической кинетики
- •1) Скорость гомогенных реакций
- •1.1)Закон действующих масс (з.Д.М.)
- •1.2) Молекулярность и порядок реакции
- •1.3) Интегрирование дифференциальных кинетических уравнений
- •1.4) Классификация реакций по степени сложности
- •1.5) Зависимость скорости реакции от температуры.
- •1.6) Принцип а. Ле-Шателье
- •2) Скорость гетерогенных реакций
- •2.1) Скорость растворение твердого тела в жидкости
- •3) Гомогенный и гетерогенный катализ
- •6. Растворы
- •1) Способы выражения концентрации растворов
- •2) Физические и химические процессы при растворении.
- •3.4) Закон распределения и коэффициент распределения
- •4) Законы ф.-м. Рауля. Эбулиоскопия и криоскопия
- •5) Растворы электролитов
- •5.1) Электролитическая диссоциация
- •5.2) Сильные и слабые электролиты. Степень диссоциации и константа диссоциации. Закон разведения Оствальда.
- •7) Гидролиз солей. Константа и степень гидролиза
- •10. Поверхностные явления
- •1) Адгезия, когезия, сорбция: адсорбция и абсорбция. Физическая адсорбция. Хемосорбция. Величина адсорбции
- •2) Механизм адсорбции
- •3) Термодинамика поверхностных явления
- •3.1) Поверхностное натяжение твёрдых тел. Принцип Гиббса-Кюри
- •3.2) Поверхностное натяжение растворов
- •4) Изотерма адсорбции Лэнгмюра, эмпирическое уравнение Фрейндлиха.
- •8. Основы электрохимии
- •1) Электродные потенциалы. Возникновение скачка потенциала на поверхности раздела "металл-раствор". Равновесны потенциал.
- •2) Теория гальванического элемента
- •2.1) Медно-цинковый элемент Якоби-Даниэля
- •2.2) Термодинамика гальванического элемента
- •3) Водородный показатель. Понятие о стандартных потенциалах. Ряд напряжений
- •4) Типы электродов и цепей
- •4.1) Окислительно-восстановительные электроды и цепи
- •5) Электролиз
- •5.1) Общие положения
- •5.2) Последовательность разряда ионов в водных растворах
- •5.3) Количественные законы электролиза (законы м. Фарадея). Удельный расход энергии
- •5.4) Поляризация. Напряжение разложения и перенапряжение
- •5.5) Практические приложение электролиза
- •6) Химические источники тока (хит)
- •6.1) Общие положения
- •6.2) Первичный хит - гальванические элементы
- •6.3) Вторичные хит-аккумуляторы
- •6.4) Топливные элементы
- •9. Коррозия металлов и методы борьбы с ней
- •1) Классификация процессов коррозии
- •2) Химическая коррозия (газовая и жидкостная)
- •3) Гальванокоррозия (микро- и макро)
- •4) Электрокоррозия
- •5) Атмосферная и почвенная коррозия
- •6) Методы борьбы с коррозией
3.1) Поверхностное натяжение твёрдых тел. Принцип Гиббса-Кюри
Та форма кристалла, которая отвечает наименьшему значению суммарной поверхности энергии всех граней обладает наибольшей устойчивостью.
3.2) Поверхностное натяжение растворов
Т = const
- изотерма поверхностного натяжения
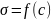
 1
и 2 - для ПАВ, 3 - ПИАВ
1
и 2 - для ПАВ, 3 - ПИАВ
Разность
 в поверхностном слое и в таком же слое
внутри объёма раствора - поверхностный
избыток вещества Г. Для ПАВ Г > 0.
в поверхностном слое и в таком же слое
внутри объёма раствора - поверхностный
избыток вещества Г. Для ПАВ Г > 0.
ПИАВ адсорбируют отрицательно, т.е. для них Г < 0.
4) Изотерма адсорбции Лэнгмюра, эмпирическое уравнение Фрейндлиха.
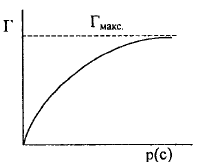
Зависимость адсорбируемого количество газа Г от давления адсорбата при постоянной температуре - изотерма адсорбции.
Если адсорбция мономолекулярная, то толщина адсорбционного слоя ограничена, и, следовательно, Г не может превышать некоторую предельную величину Гмакс.
Дж. Лэнгмюр при выводе уравнения изотермы сделал следующие допущения: а) все места адсорбента одинаковы, адсорбция на одном из них не влияет на состояние другого; б) взаимодействие между адсорбированными частицами пренебрежимо мало; в) адсорбционный слой мономолекулярен
Число конденсирующихся молекул пропорционально давлению газа р и доле поверхности, которая остаётся свободной.
Чтобы десорбироваться, молекула должна иметь энергию не ниже определённого значения λ. Чем больше λ (энергия адсорбции), тем меньше молекул десорбируется.
Процесс адсорбации экзотермичен.
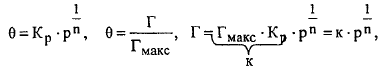 Для
адсорбации на неоднородный поверхности
было предложено эмпирическое уравнение
(Фрейндлих):
Для
адсорбации на неоднородный поверхности
было предложено эмпирическое уравнение
(Фрейндлих):
Уравнение Фрейндлиха не отражает особенностей адсорбации изотермы в области низких и высоких давлений, но для обширной области промежуточных давлений хорошо согласуется с опытными данными.
8. Основы электрохимии
 Электрохимия
- область физической химии, охватывающая
химические процессы, сопровождающиеся
возникновением электрического тока,
либо вызванные его действием.
Электрохимия
- область физической химии, охватывающая
химические процессы, сопровождающиеся
возникновением электрического тока,
либо вызванные его действием.
1) Электродные потенциалы. Возникновение скачка потенциала на поверхности раздела "металл-раствор". Равновесны потенциал.
В электрохимии электродом называется проводник первого рода, погруженный в раствор электролита в условиях прохождения через него тока.
В объёме
металла устанавливается подвижное
равновесие
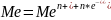 .
.
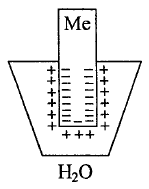 Поверхность
электрода заряжается отрицательно за
счёт оставшихся на нём электронов,
вследствие чего перешедшие в раствор
гидратированные катионы не могут отойти
от электрода и остаются вблизи него,
создавая в совокупности с электронами
так называемый двойной электрический
слой. Возникает скачок электрического
потенциала - электродный потенциал.
Поверхность
электрода заряжается отрицательно за
счёт оставшихся на нём электронов,
вследствие чего перешедшие в раствор
гидратированные катионы не могут отойти
от электрода и остаются вблизи него,
создавая в совокупности с электронами
так называемый двойной электрический
слой. Возникает скачок электрического
потенциала - электродный потенциал.
Переход ионов металла в раствор - процесс окисления, обратный процесс - превращение гидратированных ионов металла в атомы - восстановление. Потенциал, отвечающий состоянию равновесия, когда скорость перехода ионов в раствор равна скорости их осаждения - равновесный потенциал.
Для всех металлов, погружаемых в чистую воду, качественно наблюдается одинаковая картина: металл заряжается отрицательно, прилегающий слой жидкости - положительно. Количественно же наблюдается значительные различия, обусловленные различием в энергии связи катионов металлов в их кристаллических решетках и различием в энергии гидратации ионов.
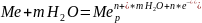 (1)
(1)
Поскольку в уравнении (1) концентрация ионов металла при погружении его в раствор соли изменится, равновесие сместится и установится вновь при другом значении потенциала. Активный металл (Zn) посылает большое число ионов в раствор, равновесная концентрация его ионов трудно достижима, и поэтому он всегда в растворе своей соли будет заряжаться отрицательно.
