
- •5. Основы химической кинетики
- •1) Скорость гомогенных реакций
- •1.1)Закон действующих масс (з.Д.М.)
- •1.2) Молекулярность и порядок реакции
- •1.3) Интегрирование дифференциальных кинетических уравнений
- •1.4) Классификация реакций по степени сложности
- •1.5) Зависимость скорости реакции от температуры.
- •1.6) Принцип а. Ле-Шателье
- •2) Скорость гетерогенных реакций
- •2.1) Скорость растворение твердого тела в жидкости
- •3) Гомогенный и гетерогенный катализ
- •6. Растворы
- •1) Способы выражения концентрации растворов
- •2) Физические и химические процессы при растворении.
- •3.4) Закон распределения и коэффициент распределения
- •4) Законы ф.-м. Рауля. Эбулиоскопия и криоскопия
- •5) Растворы электролитов
- •5.1) Электролитическая диссоциация
- •5.2) Сильные и слабые электролиты. Степень диссоциации и константа диссоциации. Закон разведения Оствальда.
- •7) Гидролиз солей. Константа и степень гидролиза
- •10. Поверхностные явления
- •1) Адгезия, когезия, сорбция: адсорбция и абсорбция. Физическая адсорбция. Хемосорбция. Величина адсорбции
- •2) Механизм адсорбции
- •3) Термодинамика поверхностных явления
- •3.1) Поверхностное натяжение твёрдых тел. Принцип Гиббса-Кюри
- •3.2) Поверхностное натяжение растворов
- •4) Изотерма адсорбции Лэнгмюра, эмпирическое уравнение Фрейндлиха.
- •8. Основы электрохимии
- •1) Электродные потенциалы. Возникновение скачка потенциала на поверхности раздела "металл-раствор". Равновесны потенциал.
- •2) Теория гальванического элемента
- •2.1) Медно-цинковый элемент Якоби-Даниэля
- •2.2) Термодинамика гальванического элемента
- •3) Водородный показатель. Понятие о стандартных потенциалах. Ряд напряжений
- •4) Типы электродов и цепей
- •4.1) Окислительно-восстановительные электроды и цепи
- •5) Электролиз
- •5.1) Общие положения
- •5.2) Последовательность разряда ионов в водных растворах
- •5.3) Количественные законы электролиза (законы м. Фарадея). Удельный расход энергии
- •5.4) Поляризация. Напряжение разложения и перенапряжение
- •5.5) Практические приложение электролиза
- •6) Химические источники тока (хит)
- •6.1) Общие положения
- •6.2) Первичный хит - гальванические элементы
- •6.3) Вторичные хит-аккумуляторы
- •6.4) Топливные элементы
- •9. Коррозия металлов и методы борьбы с ней
- •1) Классификация процессов коррозии
- •2) Химическая коррозия (газовая и жидкостная)
- •3) Гальванокоррозия (микро- и макро)
- •4) Электрокоррозия
- •5) Атмосферная и почвенная коррозия
- •6) Методы борьбы с коррозией
2) Химическая коррозия (газовая и жидкостная)
Рассмотрим
коррозию, например, двухвалентного
металла в атмосфере сухого кислорода:
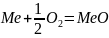 .
На поверхности металла образуется
твердая пленка оксида (см. рис.)
.
На поверхности металла образуется
твердая пленка оксида (см. рис.)
 В
объеме металла имеет место обратимый
процесс:
В
объеме металла имеет место обратимый
процесс:
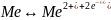 .
.
Этот же процесс протекает и на границе «Ме-оксид металла». Электроны проникают в ок- сидную пленку и ионизируют атомы кислорода, диффундирующего извне в пленку оксида.
На границе
Мe - MеO протекает реакция ,
вследствие чего плёнка медленно растет
изнутри (заштриховано на рисунке).
,
вследствие чего плёнка медленно растет
изнутри (заштриховано на рисунке).
Скорость окисления зависит от прочности пленки - в частности, от наличия или отсутствия трещин. Если плекка растягивается в процессе роста, трещины образуются легко; если сжимается, то гораздо труднее. А это в свою очередь зависит от соотношения мольных объемов продуктов коррозии Vок, и металла VМе.
Объем 1 моля
оксида
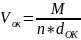 где М - молекулярная масса оксида dок
- его плоткость, n - число
атомов металла в молекуле оксида.
где М - молекулярная масса оксида dок
- его плоткость, n - число
атомов металла в молекуле оксида.
Итак, плёнка сжимается, если мольный объём е больше мольного объёма металла.
Толщина оксидных пленок колеблется от мономолекулярного слоя до 20-40 нм (200-400 A). Тонкие пленки невидимы, металл сохраняет присущий ему цвет, с увеличением же толщины пленки металл постепенно тускнеет и, наконец, при очень толстых пленках (окалина на стали, анодная пленка на алюминиии, пленки на магнии и свинце) металл приобретает цвет своего оксида.
В некоторых случаях при невысоких температурах имеет место так называемая хемосорбция атмосферного кислорода поверхностью металла, что приводит к возникновению очень тонкого слоя оксида - 1-1,5 нм (10-15 А), предохраняющего металл от коррозии.
Это явление отмечено для Ni, Cu, Сr и др. Резкие температурные колебания часто легко разрушают эту тонкую пленку, вследствие различия в коэффициентах термического расширения металла и пленки. Некоторые металлы (Fe, Al, Cr, Ti), а также нержавеющая сталь могут подвергаться «пассивации» - образованию на поверхности под действием специальных реагентов оксидных или иных слоев, что вызывает резкое замедление процессов коррозии.
Механизм «пассивации» можно представить упрощенно следующим образом. При погружении «на холоду» (при температуре, лишь незначительно превышающей 0° С) железа в концентрированную азотную кислоту протекает реакция:
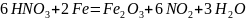
дающая устойчивую оксидную пленку.
Защитные («пассивирующие») пленки можно также создать, обрабатывая металлы растворами хроматов и нитритов. Так, стальные детали, обработанные раствором NaNO2 (60+90%-ный раствор) не ржавеют около 2 лет.
Ион CI- активирует металлы, препятствуя их пассивированию. Причиной этого является высокая адсорбируемость Cl- на металле и высокая растворимость хлоридов металлов. Ионы CI- вытесняют пассиваторы с поверхности металла, способствуя растворению «пассивирующих» пленок, что облегчает переход ионов металла в раствор.
Титановые баки для окислителя (конц. HNO3) на ракетах подвергают предварительной «пассивации». Иногда под воздействием депассиваторов (CI- и др.) пленка внезапно исчезает, что приводит к взрыву ракет на старто- вой площадке.
Активными газами, вызывающими газовую коррозию, являются Cl2, F2, SO2, Н2S, O2 и др. Так, нержавеющая сталь, Al и его сплавы, Сr устойчивы к кислороду, но неустойчивы к хлору. Никель неустойчив к SO2, тогда как медь устойчива.
Скорость газовой коррозии сталей в выхлопных газах ДВС, в топочных и печных газах зависит от соотношения СО и О2: с повышением содержания 02 скорость коррозии увеличивается, а с повышением СО уменьшается.
Со, Ni, Cu, PЬ, Сd, Tі устойчивы в атмосфере чистого водяного пара при температурах > 100° С. Жидкостная химическая коррозия - это разрушение металла в жидкой среде, не проводящей ток (нефть, бензин, керосин, смазочные масла и др.) Скорость жидкостной коррозии, как правило, невелика. Наличие даже небольших количеств влаги в указанных вешествах может значительно ускорить коррозию, сообщив ей в большей или меньшей степени электрохимический характер. Интенсифицируют процесс жидкостной коррозии и некоторые примеси, например, примесь серы в нефти.
