
- •5. Основы химической кинетики
- •1) Скорость гомогенных реакций
- •1.1)Закон действующих масс (з.Д.М.)
- •1.2) Молекулярность и порядок реакции
- •1.3) Интегрирование дифференциальных кинетических уравнений
- •1.4) Классификация реакций по степени сложности
- •1.5) Зависимость скорости реакции от температуры.
- •1.6) Принцип а. Ле-Шателье
- •2) Скорость гетерогенных реакций
- •2.1) Скорость растворение твердого тела в жидкости
- •3) Гомогенный и гетерогенный катализ
- •6. Растворы
- •1) Способы выражения концентрации растворов
- •2) Физические и химические процессы при растворении.
- •3.4) Закон распределения и коэффициент распределения
- •4) Законы ф.-м. Рауля. Эбулиоскопия и криоскопия
- •5) Растворы электролитов
- •5.1) Электролитическая диссоциация
- •5.2) Сильные и слабые электролиты. Степень диссоциации и константа диссоциации. Закон разведения Оствальда.
- •7) Гидролиз солей. Константа и степень гидролиза
- •10. Поверхностные явления
- •1) Адгезия, когезия, сорбция: адсорбция и абсорбция. Физическая адсорбция. Хемосорбция. Величина адсорбции
- •2) Механизм адсорбции
- •3) Термодинамика поверхностных явления
- •3.1) Поверхностное натяжение твёрдых тел. Принцип Гиббса-Кюри
- •3.2) Поверхностное натяжение растворов
- •4) Изотерма адсорбции Лэнгмюра, эмпирическое уравнение Фрейндлиха.
- •8. Основы электрохимии
- •1) Электродные потенциалы. Возникновение скачка потенциала на поверхности раздела "металл-раствор". Равновесны потенциал.
- •2) Теория гальванического элемента
- •2.1) Медно-цинковый элемент Якоби-Даниэля
- •2.2) Термодинамика гальванического элемента
- •3) Водородный показатель. Понятие о стандартных потенциалах. Ряд напряжений
- •4) Типы электродов и цепей
- •4.1) Окислительно-восстановительные электроды и цепи
- •5) Электролиз
- •5.1) Общие положения
- •5.2) Последовательность разряда ионов в водных растворах
- •5.3) Количественные законы электролиза (законы м. Фарадея). Удельный расход энергии
- •5.4) Поляризация. Напряжение разложения и перенапряжение
- •5.5) Практические приложение электролиза
- •6) Химические источники тока (хит)
- •6.1) Общие положения
- •6.2) Первичный хит - гальванические элементы
- •6.3) Вторичные хит-аккумуляторы
- •6.4) Топливные элементы
- •9. Коррозия металлов и методы борьбы с ней
- •1) Классификация процессов коррозии
- •2) Химическая коррозия (газовая и жидкостная)
- •3) Гальванокоррозия (микро- и макро)
- •4) Электрокоррозия
- •5) Атмосферная и почвенная коррозия
- •6) Методы борьбы с коррозией
2) Скорость гетерогенных реакций
Гетерогенными называются процессы, происходящие на поверхности раздела соприкасающихся фаз.
Скорость гетерогенных процессов зависит от размеров и состояния поверхности раздела фаз.
Если определяющей стадией является химическая реакция на поверхности раздела фаз, то гетерогенный процесс описывается законами химической кинетики (протекает в кинетической области).
Если, как это чаще бывает, наиболее медленно совершается подвод и отвод соответствующих веществ, то гетерогенный процесс описывается законами диффузии (протекает в диффузионной области).
Так, повышение температуры на каждые 10 увеличивает коэффициент диффузии для жидких и газовых сред на 20%, тогда как скорость химической реакции увеличивается в 2-4 раза.
Диффузия оказывает большое влияние на протекание гетерогенных процессов.
Рассмотри первый закон диффузии:
масса вещества
dm, переносимого путём
диффузии в направлении х через
перпендикулярную этому направлению
площадку, пропорциональна коэффициенту
диффузии D, площади S,
времени dt и градиенту
концентрации
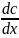 вдоль выбранного направления, т.е.
вдоль выбранного направления, т.е.
 .
.
Скорость
диффузии
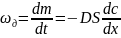 .
.
Знак "-" указывает на то, что процесс диффузии направлен в сторону понижения концентрации.
 , где Е - энергия активации диффузионного
процесса.
, где Е - энергия активации диффузионного
процесса.
Второй закон диффузии выражает зависимость изменения концентрации в объёме одной из соприкасающихся фаз от времени:

Если диффузия стационарна, то концентрация меняется только с расстоянием (х), а от времени не зависит.
При стационарно
диффузии концентрация изменяется вдоль
направления диффузии линейно, градиент
концентрации
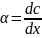 .
.
Уравнение стационарной
диффузии: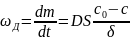
2.1) Скорость растворение твердого тела в жидкости
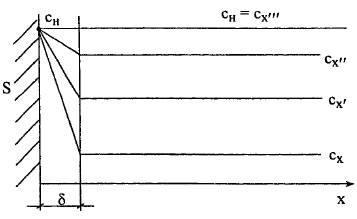 Поверхность
твердого тела, погруженного в жидкость,
- S. Химического взаимодействия
нет, сн - концентрация насыщенного
раствора на границе "тв-жд", сх
- концентрация в объёме раствора.
Поверхность
твердого тела, погруженного в жидкость,
- S. Химического взаимодействия
нет, сн - концентрация насыщенного
раствора на границе "тв-жд", сх
- концентрация в объёме раствора.
 - толщина диффузионного слоя.
- толщина диффузионного слоя.
Количество
вещества, растворяющегося в единицу
времени, - L, т.е. фактически
скорость процесса L = к(cн
- cx
)*S, где к - константа
скорости процесса,
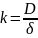 . Поскольку
. Поскольку
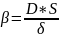 , переходим к уравнению стационарной
диффузии:
, переходим к уравнению стационарной
диффузии:

3) Гомогенный и гетерогенный катализ
Катализ - изменение скорости реакции под действием некоторых веществ - катализаторов.
Различают положительный катализ, и антикатализ, при котором скорость реакции замедляется.
Различают также автокатализ, когда реакция ускоряется собственными продуктами.
Выход реакции всегда остаётся тем же, что и без катализатора, но достигнут он будет значительно быстрее.
Различают гомогенный и гетерогенный катализ.
В первом случае реагирующие вещества и катализатор составляют одну фазу, например: А(г) + В(г) + kat(г), во втором случае реагенты и катализатор находятся в разных фазах: А(г) + В(г) + kat(тв).
Механизм гомогенного катализа может быть объяснён образованием промежуточных нестойких соединений, при этом реакции идут с меньшей энергией активации.
При гетерогенном катализе катализатор чаще всего находится в твёрдой фазе, тогда как реагирующие вещества - газы или жидкости.
Иногда достаточно простого контакта между порошкообразным катализатором и веществами для огромного увеличения скорости реакции.
Твёрдые катализаторы могут "отравляться", т.е. терять свою активность под воздействием каталитических ядов - соединений мышьяка, фосфора и др.
Согласно теории мультиплетов, существуют определённые закономерности, связывающие расстояние между атомами в превращаемой молекуле с расстоянием между активными центрами катализатора и их геометрическим расположением.
Мультиплет - активный центра на поверхности катализатора, состоящий из нескольких атомов или ионов (2, 3, 4, 6) кристаллической решетки, имеющий правильную конфигурацию, зависящую от строения всей кристаллической решетки катализатора.
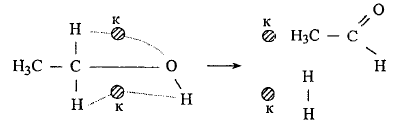
Для реакции дегидрирования, как показывает опыт, пригодны в качестве катализаторов лишь те металлы, на поверхности которых атомы расположены в виде сетки из квадратов или равносторонных треугольников.
Отрицательный катализ вызывается антикатализаторами - ингибиторами, которые часто расходуются при протекании процесса. Действие ингибиторов объясняется тем, что они связывают положительные катализаторы, либо вызывают обрыв цепей в цепных реакциях, либо адсорбируются на поверхности, где идёт химический процесс, затрудняя контакт реагентов.
С помощью ингибиторов защищают металл от коррозии в жидких средах и в атмосфере, тормозят окислительные процессы в минеральных смазочных маслах и т.д.
