
- •5. Основы химической кинетики
- •1) Скорость гомогенных реакций
- •1.1)Закон действующих масс (з.Д.М.)
- •1.2) Молекулярность и порядок реакции
- •1.3) Интегрирование дифференциальных кинетических уравнений
- •1.4) Классификация реакций по степени сложности
- •1.5) Зависимость скорости реакции от температуры.
- •1.6) Принцип а. Ле-Шателье
- •2) Скорость гетерогенных реакций
- •2.1) Скорость растворение твердого тела в жидкости
- •3) Гомогенный и гетерогенный катализ
- •6. Растворы
- •1) Способы выражения концентрации растворов
- •2) Физические и химические процессы при растворении.
- •3.4) Закон распределения и коэффициент распределения
- •4) Законы ф.-м. Рауля. Эбулиоскопия и криоскопия
- •5) Растворы электролитов
- •5.1) Электролитическая диссоциация
- •5.2) Сильные и слабые электролиты. Степень диссоциации и константа диссоциации. Закон разведения Оствальда.
- •7) Гидролиз солей. Константа и степень гидролиза
- •10. Поверхностные явления
- •1) Адгезия, когезия, сорбция: адсорбция и абсорбция. Физическая адсорбция. Хемосорбция. Величина адсорбции
- •2) Механизм адсорбции
- •3) Термодинамика поверхностных явления
- •3.1) Поверхностное натяжение твёрдых тел. Принцип Гиббса-Кюри
- •3.2) Поверхностное натяжение растворов
- •4) Изотерма адсорбции Лэнгмюра, эмпирическое уравнение Фрейндлиха.
- •8. Основы электрохимии
- •1) Электродные потенциалы. Возникновение скачка потенциала на поверхности раздела "металл-раствор". Равновесны потенциал.
- •2) Теория гальванического элемента
- •2.1) Медно-цинковый элемент Якоби-Даниэля
- •2.2) Термодинамика гальванического элемента
- •3) Водородный показатель. Понятие о стандартных потенциалах. Ряд напряжений
- •4) Типы электродов и цепей
- •4.1) Окислительно-восстановительные электроды и цепи
- •5) Электролиз
- •5.1) Общие положения
- •5.2) Последовательность разряда ионов в водных растворах
- •5.3) Количественные законы электролиза (законы м. Фарадея). Удельный расход энергии
- •5.4) Поляризация. Напряжение разложения и перенапряжение
- •5.5) Практические приложение электролиза
- •6) Химические источники тока (хит)
- •6.1) Общие положения
- •6.2) Первичный хит - гальванические элементы
- •6.3) Вторичные хит-аккумуляторы
- •6.4) Топливные элементы
- •9. Коррозия металлов и методы борьбы с ней
- •1) Классификация процессов коррозии
- •2) Химическая коррозия (газовая и жидкостная)
- •3) Гальванокоррозия (микро- и макро)
- •4) Электрокоррозия
- •5) Атмосферная и почвенная коррозия
- •6) Методы борьбы с коррозией
2) Теория гальванического элемента
2.1) Медно-цинковый элемент Якоби-Даниэля
Гальванической элемент - любое устройство, дающее возможность получать электрический ток за счёт проведения той или иной химической реакции.
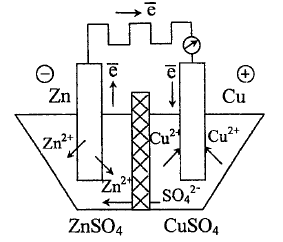 Рассмотрим
систему, в которой медь и цинк в воде
пластинок помещены в растворы своих
солей, разделённых пористой керамической
перегородкой - диафрагмой. При
разомкнутой внешней цепи на обоих
электродах устанавливаются равновесные
потенциалы, различающиеся по величине
и по знаку. При замыкании внешней цепи
на некоторое сопротивление электроны
от цинкового электрода получают
возможность перемещаться по внешнему
проводнику к медному электроду.
Рассмотрим
систему, в которой медь и цинк в воде
пластинок помещены в растворы своих
солей, разделённых пористой керамической
перегородкой - диафрагмой. При
разомкнутой внешней цепи на обоих
электродах устанавливаются равновесные
потенциалы, различающиеся по величине
и по знаку. При замыкании внешней цепи
на некоторое сопротивление электроны
от цинкового электрода получают
возможность перемещаться по внешнему
проводнику к медному электроду.
Равновесие
на цинковом электроде нарушается, и для
пополнения убыли электронов получает
развитие процесс:
,
при этом в раствор переходит ионы
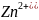 .
.
Электроны,
проходящие к медному электроду,
восстанавливают ионы
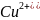 по
реакции:
Равновесие нарушается и на медном
электроде, поэтому из раствора к медному
электроду поступают все новые порции
.
по
реакции:
Равновесие нарушается и на медном
электроде, поэтому из раствора к медному
электроду поступают все новые порции
.
Таким образом, в системе получают развитие два территориально разобщённых процесса:
на отрицательном
электроде -
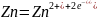 (окисление);
(окисление);
на положительном
электроде -
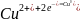 (восстановление).
(восстановление).
Суммарная
реакция
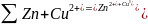 ,
а в молекулярной форме:
,
а в молекулярной форме:

Гальванический элемент, основанный на такой реакции, был предложен русским учёным Б.С.Якоби. Создателем этого элемента является также и английский учёный Даниэль.
Причина возникновения электрического тока - разность потенциалов, возникающих на пластинках.
Гальваническая цепь - последовательная совокупность всех скачков потенциала на различных поверхностях раздела, отвечающих данному гальваническому элементу.
Гальваническая цепь медно-цинкового элемента записывается следующим образом:
Граница "электрод-электролит" обозначается одной вертикальной чертой, двумя обозначается граница двух электролитов, на которой устранён диффузионный потенциал. Электроны перемещаются по внешнему проводнику слева направо, и в том же направлении переносится ионами положительное электричество внутри элемента. При такой записи гальванической цепи ЭДС элемента всегда считается положительной, поскольку эта запись отвечает направлению самопроизвольного протекания реакции, сопровождающегося уменьшением изобарно-изотермического потенциала.
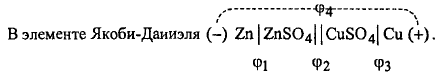
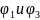 - скачки потенциалов на границах
"электрод-электролит",
- скачки потенциалов на границах
"электрод-электролит",
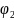 - на границе двух электролитов,
- на границе двух электролитов,
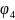 - на границе двух металлов. Величиной
можно пренебречь.
- на границе двух металлов. Величиной
можно пренебречь.
2.2) Термодинамика гальванического элемента
ЭДС гальванического элемента зависит от природы реагирующих веществ, их концентрации и температуры.
Влияние природы реагирующих веществ
Пусть в гальваническом элемента протекает реакция 1:
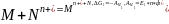 .
.
 .
.
Здесь
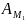 - максимальная полезная работа
реакции.
- максимальная полезная работа
реакции.
При протекании реакции 2 имеем:
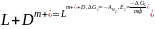 .
.
Влияние температуры на ЭДС элемента
Уравнение
Гиббса-Гельмгольца:
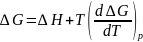 .
сделаем подстановки в это уравнение:
.
сделаем подстановки в это уравнение:
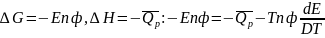 ,
,
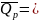
 .
Обозначим второе слагаемое через
.
Обозначим второе слагаемое через
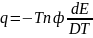 , получаем
, получаем
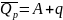 ,
поскольку
,
поскольку
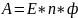 .
.
 - теплота реакции, которая выделяется
или поглощается при её необратимом
проведении.
- теплота реакции, которая выделяется
или поглощается при её необратимом
проведении.
q характеризует связанную энергию, определяет количество теплоты, неизбежно выделяющейся или поглощающейся при обратимой работе элемента.
Поскольку
 Таким образом, определив температурный
градиент ЭДС, можно вычислить изменение
энтропии для реакции, протекающей в
элементе.
Таким образом, определив температурный
градиент ЭДС, можно вычислить изменение
энтропии для реакции, протекающей в
элементе.
Зависимость ЭДС от концентрации реагирующих веществ
Пусть в гальваническом элементе протекает реакция A + B = 2D.
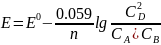 - уравнение
Нернста.
- уравнение
Нернста.
