
- •5. Основы химической кинетики
- •1) Скорость гомогенных реакций
- •1.1)Закон действующих масс (з.Д.М.)
- •1.2) Молекулярность и порядок реакции
- •1.3) Интегрирование дифференциальных кинетических уравнений
- •1.4) Классификация реакций по степени сложности
- •1.5) Зависимость скорости реакции от температуры.
- •1.6) Принцип а. Ле-Шателье
- •2) Скорость гетерогенных реакций
- •2.1) Скорость растворение твердого тела в жидкости
- •3) Гомогенный и гетерогенный катализ
- •6. Растворы
- •1) Способы выражения концентрации растворов
- •2) Физические и химические процессы при растворении.
- •3.4) Закон распределения и коэффициент распределения
- •4) Законы ф.-м. Рауля. Эбулиоскопия и криоскопия
- •5) Растворы электролитов
- •5.1) Электролитическая диссоциация
- •5.2) Сильные и слабые электролиты. Степень диссоциации и константа диссоциации. Закон разведения Оствальда.
- •7) Гидролиз солей. Константа и степень гидролиза
- •10. Поверхностные явления
- •1) Адгезия, когезия, сорбция: адсорбция и абсорбция. Физическая адсорбция. Хемосорбция. Величина адсорбции
- •2) Механизм адсорбции
- •3) Термодинамика поверхностных явления
- •3.1) Поверхностное натяжение твёрдых тел. Принцип Гиббса-Кюри
- •3.2) Поверхностное натяжение растворов
- •4) Изотерма адсорбции Лэнгмюра, эмпирическое уравнение Фрейндлиха.
- •8. Основы электрохимии
- •1) Электродные потенциалы. Возникновение скачка потенциала на поверхности раздела "металл-раствор". Равновесны потенциал.
- •2) Теория гальванического элемента
- •2.1) Медно-цинковый элемент Якоби-Даниэля
- •2.2) Термодинамика гальванического элемента
- •3) Водородный показатель. Понятие о стандартных потенциалах. Ряд напряжений
- •4) Типы электродов и цепей
- •4.1) Окислительно-восстановительные электроды и цепи
- •5) Электролиз
- •5.1) Общие положения
- •5.2) Последовательность разряда ионов в водных растворах
- •5.3) Количественные законы электролиза (законы м. Фарадея). Удельный расход энергии
- •5.4) Поляризация. Напряжение разложения и перенапряжение
- •5.5) Практические приложение электролиза
- •6) Химические источники тока (хит)
- •6.1) Общие положения
- •6.2) Первичный хит - гальванические элементы
- •6.3) Вторичные хит-аккумуляторы
- •6.4) Топливные элементы
- •9. Коррозия металлов и методы борьбы с ней
- •1) Классификация процессов коррозии
- •2) Химическая коррозия (газовая и жидкостная)
- •3) Гальванокоррозия (микро- и макро)
- •4) Электрокоррозия
- •5) Атмосферная и почвенная коррозия
- •6) Методы борьбы с коррозией
7) Гидролиз солей. Константа и степень гидролиза
Кислота - вещество, молекулы которого в водном растворе в качестве катионов образуют только ионы водорода.
Основание - в качестве анионов образует только анионы гидроксила.
Амфотерные электролиты ведут себя в зависимости от рН среды.
Нейтрализация - реакция между кислотой и основанием.
Гидролиз - процесс, обратный нейтрализации, приводящий к образованию основания и кислоты.
Рассмотрим несколько случаев гидролиза:
1. Соль образовано слабой кислотой и сильным основанием - СН3СOONa.

2. Соль образована слабой двухосновной кислотой и сильным основанием.
Гидролиз идёт ступенчато
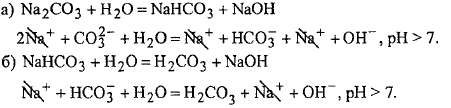 3.
Соль образована слабым основанием и
сильной кислотой.
3.
Соль образована слабым основанием и
сильной кислотой.
![]()
4. Соль образована слабым трёхатомным основанием и сильной кислотой. Гидролиз идёт ступенчато
![]()
5. Соль, образованная сильным основанием и сильной кислотой, гидролизу не подвергается.
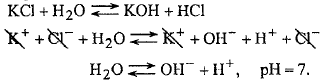
6. Соль образована слабой кислотой и слабым основанием - CH3COONH4
7. ![]() Соль
образована очень слабым основанием и
очень слабой кислотой - Al2S3
полностью гидролитически разлагается:
Соль
образована очень слабым основанием и
очень слабой кислотой - Al2S3
полностью гидролитически разлагается:
Для
характеристики реакций гидролиза 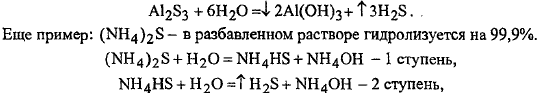 при
данной концентрации применяют степень
гидролиза h:
при
данной концентрации применяют степень
гидролиза h:
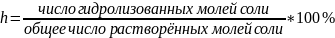
Разбавление раствора смещает равновесие гидролиза вправо, подкисление - влево.
10. Поверхностные явления
1) Адгезия, когезия, сорбция: адсорбция и абсорбция. Физическая адсорбция. Хемосорбция. Величина адсорбции
Адгезия - проявление межмолекулярных сил между разнородными молекулами (А - В).
Когезия - между однородными молекулами, это связи типа А - А или В - В.
Сорбция - процесс поглощение одного вещества поверхностью или всем объёмом другого вещества. Поглощаемое вещество - сорбат, поглотитель - сорбент.
Адсорбция - это фактически процесс сгущения вещества в пограничном слое у поверхности раздела фаз.
Физическая адсорбция: адсорбат или адсорбент связаны лишь слабыми силами межмолекулярного взаимодействия.
При хемосорбции поглощаемое вещество химически взаимодействует с поглотителем.
Адсорбционная
способность адсорбента определяется
по удельной площади поверхности

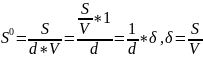
- степень дисперсности адсорбента
Величина адсорбции - способность адсорбента поглощать адсорбат - это избыток массы адсорбата в пограничном слое над массой его в равном объёме окружающей среды, отнесенный к единице поверхности адсорбента (моль/см2)
2) Механизм адсорбции
Адсорбция связана с особым энергетическим состоянием частиц на поверхности в отличие от энергетического состояния частиц, находящихся в его объёме.
Избыток
свободной энергии в поверхностном слое,
отнесённый к 1 см2 поверхности
поглощающего тела, носит название
поверхностного натяжения
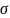 .
.
За счёт избыточной энергии и происходит притяжение поверхностью адсорбента молекул газов и растворённых веществ.
3) Термодинамика поверхностных явления
При образовании
поверхности площадью
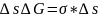 ,
где
- фактор интенсивности, а
,
где
- фактор интенсивности, а
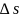 - фактор экстенсивности (ёмкости).
- фактор экстенсивности (ёмкости).
Ранее было
показано:
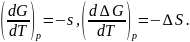
Принебрегая изменением величина поверхности с температурой, имеем:
 ,
откуда
,
откуда
 .
.
Из
 следует
следует
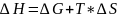 ,
т.е.
,
т.е.
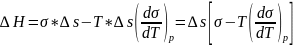 .
.
Поскольку
с ростом Т поверхностное натяжение
уменьшается
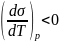 ,
из
следует,
что
,
из
следует,
что
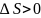 ,
т.е. образование новой поверхности
сопровождается увеличением энтропии.
,
т.е. образование новой поверхности
сопровождается увеличением энтропии.
При постоянстве поверхностного натяжения самопроизвольно могут протекать процессы, сопровождающиеся уменьшением поверхности, а не увеличением её.
В отсутствие каких-либо воздействий жидкость стремится уменьшить свою поверхность, поскольку это приводит к уменьшению G - энергии Гиббса. Поэтому жидкость стремится принять форму сферической капли.
Все самопроизвольные процесс на границе раздела фаз происходят в направлении уменьшении свободной поверхностной энергии.
