
- •5. Основы химической кинетики
- •1) Скорость гомогенных реакций
- •1.1)Закон действующих масс (з.Д.М.)
- •1.2) Молекулярность и порядок реакции
- •1.3) Интегрирование дифференциальных кинетических уравнений
- •1.4) Классификация реакций по степени сложности
- •1.5) Зависимость скорости реакции от температуры.
- •1.6) Принцип а. Ле-Шателье
- •2) Скорость гетерогенных реакций
- •2.1) Скорость растворение твердого тела в жидкости
- •3) Гомогенный и гетерогенный катализ
- •6. Растворы
- •1) Способы выражения концентрации растворов
- •2) Физические и химические процессы при растворении.
- •3.4) Закон распределения и коэффициент распределения
- •4) Законы ф.-м. Рауля. Эбулиоскопия и криоскопия
- •5) Растворы электролитов
- •5.1) Электролитическая диссоциация
- •5.2) Сильные и слабые электролиты. Степень диссоциации и константа диссоциации. Закон разведения Оствальда.
- •7) Гидролиз солей. Константа и степень гидролиза
- •10. Поверхностные явления
- •1) Адгезия, когезия, сорбция: адсорбция и абсорбция. Физическая адсорбция. Хемосорбция. Величина адсорбции
- •2) Механизм адсорбции
- •3) Термодинамика поверхностных явления
- •3.1) Поверхностное натяжение твёрдых тел. Принцип Гиббса-Кюри
- •3.2) Поверхностное натяжение растворов
- •4) Изотерма адсорбции Лэнгмюра, эмпирическое уравнение Фрейндлиха.
- •8. Основы электрохимии
- •1) Электродные потенциалы. Возникновение скачка потенциала на поверхности раздела "металл-раствор". Равновесны потенциал.
- •2) Теория гальванического элемента
- •2.1) Медно-цинковый элемент Якоби-Даниэля
- •2.2) Термодинамика гальванического элемента
- •3) Водородный показатель. Понятие о стандартных потенциалах. Ряд напряжений
- •4) Типы электродов и цепей
- •4.1) Окислительно-восстановительные электроды и цепи
- •5) Электролиз
- •5.1) Общие положения
- •5.2) Последовательность разряда ионов в водных растворах
- •5.3) Количественные законы электролиза (законы м. Фарадея). Удельный расход энергии
- •5.4) Поляризация. Напряжение разложения и перенапряжение
- •5.5) Практические приложение электролиза
- •6) Химические источники тока (хит)
- •6.1) Общие положения
- •6.2) Первичный хит - гальванические элементы
- •6.3) Вторичные хит-аккумуляторы
- •6.4) Топливные элементы
- •9. Коррозия металлов и методы борьбы с ней
- •1) Классификация процессов коррозии
- •2) Химическая коррозия (газовая и жидкостная)
- •3) Гальванокоррозия (микро- и макро)
- •4) Электрокоррозия
- •5) Атмосферная и почвенная коррозия
- •6) Методы борьбы с коррозией
3.4) Закон распределения и коэффициент распределения
В систему из дух несмешивающихся жидкостей I и II введено вещество III, концентрация которого в жидкостях с1 и с2. Согласно закону распределения, соотношение концентраций при Т = const есть величина постоянная, именуемая коэффициентом распределения L:
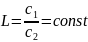
L - константа, не зависящая от количества растворённого вещества в обеих жидкостях. Она определяется природой растворителей, природой растворённого вещества и температурой.
Закон Генри - частный случай более общего закона распределения.
4) Законы ф.-м. Рауля. Эбулиоскопия и криоскопия
Согласно первому закону Рауля, давление пара растворителя над раствором пропорционально мольной доле растворителя в растворе.
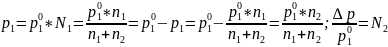
Относительное понижение давления пара растворителя над раствором равно мольной доли растворённого вещества.
Это вторая формулировка 1-го закона Рауля.
Графическое изображение 1-го закона Рауля.
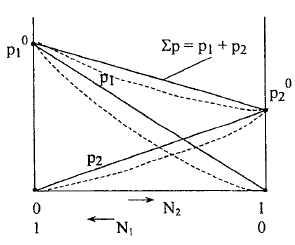 Если
система полностью подчиняется закону
Рауля, на графике будут наблюдаться
прямолинейные зависимости.
Если
система полностью подчиняется закону
Рауля, на графике будут наблюдаться
прямолинейные зависимости.
Температура замерзания раствора ниже температуры замерзания растворителя, а температуры кипения - выше.
Согласно второму закону Рауля, повышение температуры кипения раствора и понижение температуры его замерзания пропорциональны моляльной концентрации раствора.
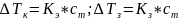
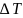 не зависит от природы растворённого
вещества, а определяется природой
растворителя и моляльностью, т.е. числом
растворённых молекул в определённого
количестве растворителя.
не зависит от природы растворённого
вещества, а определяется природой
растворителя и моляльностью, т.е. числом
растворённых молекул в определённого
количестве растворителя.
С помощью
закона Рауля можно определять неизвестные
молекулярные массы растворённых веществ.
Если определяется
 раствора, то метод носит название
эбулиоскопия, если
раствора, то метод носит название
эбулиоскопия, если
 - криосокпия.
- криосокпия.
5) Растворы электролитов
Электролиты вещества, которые в растворе или в расплаве состоят полностью или частично из ионов. Электролиты - проводники 2-го рода - с ионной проводимостью в отличие от металлов - проводников 1-го рода ( с электронной проводимостью).
Электролиты не подчиняются законам Рауля: растворы их замерзают при температурах более низких, а кипят при температурах более высоких, чем растворы неэлектролитов той же моляльной концентрации.
5.1) Электролитическая диссоциация
Согласно закону Кулона, сила f электростатического притяжения между зарядами е1 и е2 , находящимися на расстоянии r друг от друга в среде с диэлектрической проницаемостью E:
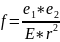
5.2) Сильные и слабые электролиты. Степень диссоциации и константа диссоциации. Закон разведения Оствальда.
По способности к диссоциации электролиты подразделяются на сильные и слабые.
Сильные электролиты практические полностью диссоциируют на ионы, т.е. этот процесс необратим. Процесс диссоциации слабых электролитов является обратимым. Степень диссоциации α - та доля растворённого электролита, которая распалась на ионы. Истинная степень диссоциации в растворах сильных электролитов равна 1.
X - величина, обратная удельному электросопротивлению.
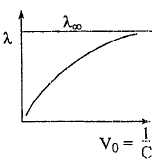
λ - электропроводность такого объёма раствора, в котором содержится 1 г-экв. растворённого вещества.
λ повышается с увеличением разбавления до некоторой предельной величина, когда все молекулы распадаются на ионы (α = 1), при этом предельное значение эквивалентной электропроводимости λпред носит название электропроводимость при бесконечном разбавлении λбеск.
 Таким
образом,
Таким
образом,
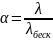 .
Это положение справедливо лишь для
слабых электролитов.
.
Это положение справедливо лишь для
слабых электролитов.
Для сильных электролитов λ - просто отношение электропроводимостей.
Процесс диссоциации слабых электролитов обратим, например,

Константа диссоциации этого процесса в случае разбавленного электролита:
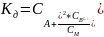
Константа диссоциации КД в одном и том же растворителе при постоянной температуре - величина постоянная, она свойственна данному электролиту.
Степень же диссоциации α характеризует состояние электролита в растворе только данной концентрации и меняется с изменением ее.
При повышении концентрации раствора α уменьшается.
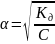 - закон разведение Оствальда.
- закон разведение Оствальда.
С разбавлением раствора степень диссоциации его увеличивается.

К сильным электролитам относятся почти все соли; большинство минеральных кислот; гидроксиды щелочных и щелочноземельных металлов.
Слабые электролиты: почти все органические кислоты, некоторые минеральные кислоты и т.д.
Электролиты средней силы: Н3РО4, Н2С2О4 и др.
5.3) Состояние сильных электролитов в растворе
Каждый ион окружается как бы роем ионов - ионной атмосферой.
Для сильных электролитов введено понятие активной концентрации ионов, учитывающей все виды взаимодействия между ионами. Активность определяется как величина, подстановка которой вместо концентрации в термодинамические уравнения, действительные для идеальных систем, делает их применимыми и к реальным системам.
5.4) Произведение растворимости
Имеем сильный электролит - какую-либо трудно-растворимую соль, в насыщенном растворе её кристаллы находятся в равновесии с перешедшими в раствор ионами:
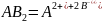
В насыщенном растворе трудно-растворимого электролиты произведение концентраций его ионов при данной температуре есть величина постоянная, называемая произведением растворимости ПР.
6) Электролитическая диссоциация. Ионное произведение воды. Водородный показатель
В чистой
воде или нейтральном растворе
 это
условие нейстральности:
это
условие нейстральности:
Степень
диссоциации воды
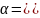 .
.
Если >10-7, среда кислая; <10-7 - среда щелочная; при = 10-7 - нейтральная.
6.1) Понятие об индикаторах
Индикатор - вещество, имеющее различную окраску в зависимости от концентрации ионов водорода.
Схема
диссоциации индикатора-кислоты:

Схема
диссоциации основания:
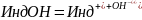
Лакмус и фенолфталеин являются кислотами: молекулы лакмуса окрашены в красный цвет, а его ионы Инд- в синий; молекулы фенолфталеина - бесцветны, а ионы Инд- имеют интенсивную малиновую окраску. Изменение окраски индикаторов связано с перестройкой молекул, точнее, с перегруппировкой атомов.
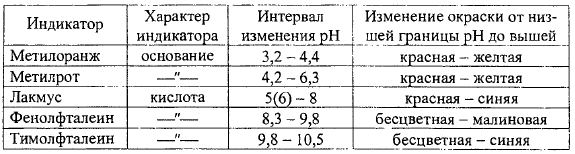 Смесь
индикаторов - так называемый универсальный
индикатор - позволяет находить рН в
широком интервале. В полевых условиях
используют полоски бумаги, пропитанные
универсальным индикатором, и цветную
шкалу для сравнения.
Смесь
индикаторов - так называемый универсальный
индикатор - позволяет находить рН в
широком интервале. В полевых условиях
используют полоски бумаги, пропитанные
универсальным индикатором, и цветную
шкалу для сравнения.
