
- •5. Основы химической кинетики
- •1) Скорость гомогенных реакций
- •1.1)Закон действующих масс (з.Д.М.)
- •1.2) Молекулярность и порядок реакции
- •1.3) Интегрирование дифференциальных кинетических уравнений
- •1.4) Классификация реакций по степени сложности
- •1.5) Зависимость скорости реакции от температуры.
- •1.6) Принцип а. Ле-Шателье
- •2) Скорость гетерогенных реакций
- •2.1) Скорость растворение твердого тела в жидкости
- •3) Гомогенный и гетерогенный катализ
- •6. Растворы
- •1) Способы выражения концентрации растворов
- •2) Физические и химические процессы при растворении.
- •3.4) Закон распределения и коэффициент распределения
- •4) Законы ф.-м. Рауля. Эбулиоскопия и криоскопия
- •5) Растворы электролитов
- •5.1) Электролитическая диссоциация
- •5.2) Сильные и слабые электролиты. Степень диссоциации и константа диссоциации. Закон разведения Оствальда.
- •7) Гидролиз солей. Константа и степень гидролиза
- •10. Поверхностные явления
- •1) Адгезия, когезия, сорбция: адсорбция и абсорбция. Физическая адсорбция. Хемосорбция. Величина адсорбции
- •2) Механизм адсорбции
- •3) Термодинамика поверхностных явления
- •3.1) Поверхностное натяжение твёрдых тел. Принцип Гиббса-Кюри
- •3.2) Поверхностное натяжение растворов
- •4) Изотерма адсорбции Лэнгмюра, эмпирическое уравнение Фрейндлиха.
- •8. Основы электрохимии
- •1) Электродные потенциалы. Возникновение скачка потенциала на поверхности раздела "металл-раствор". Равновесны потенциал.
- •2) Теория гальванического элемента
- •2.1) Медно-цинковый элемент Якоби-Даниэля
- •2.2) Термодинамика гальванического элемента
- •3) Водородный показатель. Понятие о стандартных потенциалах. Ряд напряжений
- •4) Типы электродов и цепей
- •4.1) Окислительно-восстановительные электроды и цепи
- •5) Электролиз
- •5.1) Общие положения
- •5.2) Последовательность разряда ионов в водных растворах
- •5.3) Количественные законы электролиза (законы м. Фарадея). Удельный расход энергии
- •5.4) Поляризация. Напряжение разложения и перенапряжение
- •5.5) Практические приложение электролиза
- •6) Химические источники тока (хит)
- •6.1) Общие положения
- •6.2) Первичный хит - гальванические элементы
- •6.3) Вторичные хит-аккумуляторы
- •6.4) Топливные элементы
- •9. Коррозия металлов и методы борьбы с ней
- •1) Классификация процессов коррозии
- •2) Химическая коррозия (газовая и жидкостная)
- •3) Гальванокоррозия (микро- и макро)
- •4) Электрокоррозия
- •5) Атмосферная и почвенная коррозия
- •6) Методы борьбы с коррозией
1.4) Классификация реакций по степени сложности
Изолированные реакции - при их протекании образуются продукты только одного типа.
Параллельные реакции - в ходе них взятые вещества одновременно реагируют в двух или более направлениях.
![]() Схематично:
Схематично:
Наблюдаемая
скорость реакции:

Для параллельной мономолекулярной реакции:
![]()
можно написать
 ,
где х - количество молей А, израсходованных
к моменту времени , "а" - число
молей А в начальный момент.
,
где х - количество молей А, израсходованных
к моменту времени , "а" - число
молей А в начальный момент.
После интегрирования:
Сопряженные реакции - совместные реакции вида:
![]()
Последовательные (многоступенчатые) реакции:
![]()
Обратимые и необратимые реакции.
Наблюдаемая
скорость обратимой реакции

Существуют реакции, в которых доминирует процесс, идущий в одном направлении, поскольку продукты реакции быстро удаляются из системы: выпадение осадка, газа и т.д.
В какой-то мере эти реакции все же обратимы, их можно считать лишь практически необратимыми.
Для совершенно
необратимых реакций скорости прямого
и обратного процессов несоизмеримы:

Когда скорости сравниваются, устанавливается подвижное равновесие
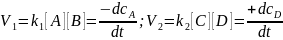
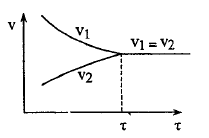 При
неизменных условия химическое равновесие
может сохраняться сколь угодно долго.
При
неизменных условия химическое равновесие
может сохраняться сколь угодно долго.
1.5) Зависимость скорости реакции от температуры.
Энергия активации
Согласно эмпирическому правилу Вант-Гоффа, повышение температуры на каждые 10 увеличивает скорость реакции в 2-4 раза.
Увеличение скорости реакции нельзя объяснить увеличением скоростей движения молекул и учащением вследствие этого столкновений.
С ростом температуры происходит перераспределение энергии между молекулами таким образом, что резко возрастает число активных молекул, обладающих некоторым избытком энергии (энергией активации).
С. Аррениус
установил:
 , где к - константа скорости реакции, а
А и В - индивидуальные постоянные,
характерные для данной реакции. Каков
физический смысл постоянных А и В?
, где к - константа скорости реакции, а
А и В - индивидуальные постоянные,
характерные для данной реакции. Каков
физический смысл постоянных А и В?

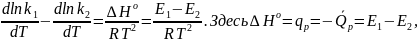 т.е.
представлена как разность двух
энергетических величин, относящихся к
прямой и обратной реакциям.
т.е.
представлена как разность двух
энергетических величин, относящихся к
прямой и обратной реакциям.

Допущения,
сделанные Аррениусом:


Здесь Е1
и Е2 - энергии активации прямой и
обратной реакции. Ранее имели:
,
следовательно

Каков физический смысл энергии активации? Рассмотрим график изменения энергии в процессе протекания экзотермической реакции: A + B = C + D
 Уровень
L отвечает тому наименьшему
запасу энергии у молекул, который
необходим для их результативного
столкновения. Разность уровней L
и I - это энергия активации
прямой реакции, L и II-
обратной.
Уровень
L отвечает тому наименьшему
запасу энергии у молекул, который
необходим для их результативного
столкновения. Разность уровней L
и I - это энергия активации
прямой реакции, L и II-
обратной.
Для эндотермической реакции:

1.6) Принцип а. Ле-Шателье
Гласит: если в систему, находящуюся в истинном химическом равновесии, оказывают воздействие извне путём изменения какого-либо из условий, определяющих положение равновесия, то оно смещается в направлении той реакции, протекание которой ослабляет эффект произведенного воздействия.
а) Влияние температуры
Повышение температуры смещает равновесие в сторону процесса, идущего с поглощение тепла.
б) Влияние давления
Рост давления смещает равновесие в сторону меньшего числа молей, т.е. в сторону падения давления.
в) Влияние концентрации
При увеличение концентрации равновесие смещается в сторону реакции, потребляющей эти вещества.
