
- •5. Основы химической кинетики
- •1) Скорость гомогенных реакций
- •1.1)Закон действующих масс (з.Д.М.)
- •1.2) Молекулярность и порядок реакции
- •1.3) Интегрирование дифференциальных кинетических уравнений
- •1.4) Классификация реакций по степени сложности
- •1.5) Зависимость скорости реакции от температуры.
- •1.6) Принцип а. Ле-Шателье
- •2) Скорость гетерогенных реакций
- •2.1) Скорость растворение твердого тела в жидкости
- •3) Гомогенный и гетерогенный катализ
- •6. Растворы
- •1) Способы выражения концентрации растворов
- •2) Физические и химические процессы при растворении.
- •3.4) Закон распределения и коэффициент распределения
- •4) Законы ф.-м. Рауля. Эбулиоскопия и криоскопия
- •5) Растворы электролитов
- •5.1) Электролитическая диссоциация
- •5.2) Сильные и слабые электролиты. Степень диссоциации и константа диссоциации. Закон разведения Оствальда.
- •7) Гидролиз солей. Константа и степень гидролиза
- •10. Поверхностные явления
- •1) Адгезия, когезия, сорбция: адсорбция и абсорбция. Физическая адсорбция. Хемосорбция. Величина адсорбции
- •2) Механизм адсорбции
- •3) Термодинамика поверхностных явления
- •3.1) Поверхностное натяжение твёрдых тел. Принцип Гиббса-Кюри
- •3.2) Поверхностное натяжение растворов
- •4) Изотерма адсорбции Лэнгмюра, эмпирическое уравнение Фрейндлиха.
- •8. Основы электрохимии
- •1) Электродные потенциалы. Возникновение скачка потенциала на поверхности раздела "металл-раствор". Равновесны потенциал.
- •2) Теория гальванического элемента
- •2.1) Медно-цинковый элемент Якоби-Даниэля
- •2.2) Термодинамика гальванического элемента
- •3) Водородный показатель. Понятие о стандартных потенциалах. Ряд напряжений
- •4) Типы электродов и цепей
- •4.1) Окислительно-восстановительные электроды и цепи
- •5) Электролиз
- •5.1) Общие положения
- •5.2) Последовательность разряда ионов в водных растворах
- •5.3) Количественные законы электролиза (законы м. Фарадея). Удельный расход энергии
- •5.4) Поляризация. Напряжение разложения и перенапряжение
- •5.5) Практические приложение электролиза
- •6) Химические источники тока (хит)
- •6.1) Общие положения
- •6.2) Первичный хит - гальванические элементы
- •6.3) Вторичные хит-аккумуляторы
- •6.4) Топливные элементы
- •9. Коррозия металлов и методы борьбы с ней
- •1) Классификация процессов коррозии
- •2) Химическая коррозия (газовая и жидкостная)
- •3) Гальванокоррозия (микро- и макро)
- •4) Электрокоррозия
- •5) Атмосферная и почвенная коррозия
- •6) Методы борьбы с коррозией
5.3) Количественные законы электролиза (законы м. Фарадея). Удельный расход энергии
Первый закон: при электролизе данного электролита количества веществ, выделяющихся на электродах, прямо пропорционально количеству электричества, прошедшему через электролит;
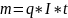 ; q - химический эквивалент.
; q - химический эквивалент.
Второй закон: при электролизе различных электролитов одинаковые количества электричества выделяют на электродах такие количество веществ, которое прямо пропорционально их химическим эквивалентам.
При прохождении 1 фарадея (96500 Кл) электричества на электродах выделяется по 1 г-экв. вещества (при 100%-ном выходе по току). n - выход по току:

5.4) Поляризация. Напряжение разложения и перенапряжение
В процессе электролиза всегда возникает некоторая разность потенциалов, направленная противоположно той, которая накладывается извне. Это явление носит название "поляризация". Различают химическую и концентрациооную поляризацию.
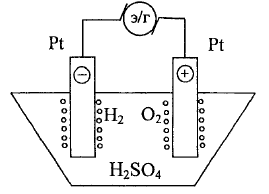 Рассмотрим
электролиз раствора Н2SO4
c Pt-электродами:
Рассмотрим
электролиз раствора Н2SO4
c Pt-электродами:
(-) катод:
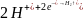
(+) анод:
Для того,
чтобы газы удалялись в виде пузырьков,
необходимо, чтобы их парциальные давления
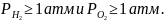
При парциальных
давлениях
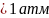 удаление газов будет носить диффузный
характер, т.е. будет происходить очень
медленно.
удаление газов будет носить диффузный
характер, т.е. будет происходить очень
медленно.
Для того,
чтобы давление газов равнялось 1 атм,
необходимо приложить стандартную ЭДС,
отвещающую стандартной свободной
энергии Гиббса для реакции образования
воды
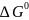 .
.
Если внешняя
ЭДС
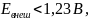 то
электролиз практически не идёт из-за
медленности удаления газов. Из-за
адсорбции
то
электролиз практически не идёт из-за
медленности удаления газов. Из-за
адсорбции
 на
Pt-электродах система
начинает функционировать как
водородно-кислородный гальванический
элемент, ЭДС которого направлена
навстречу внешней ЭДС. Данная поляризация
обусловлена химическими изменениями
на поверхности электродов и поэтому
носит название химической.
на
Pt-электродах система
начинает функционировать как
водородно-кислородный гальванический
элемент, ЭДС которого направлена
навстречу внешней ЭДС. Данная поляризация
обусловлена химическими изменениями
на поверхности электродов и поэтому
носит название химической.
Перенапряжение - это разность между напряжением разложения, фактически необходимым для протекания электролиза в данной электрохимической системе, и ЭДС газьванического элемента, отвечающего этой системе.
Рассмотрим концентрационную поляризацию.
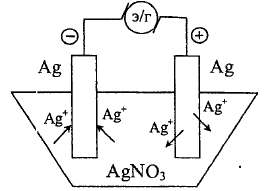 Два
серебрянных электрода помещены в раствор
AgNO3. Без наложения
внешней поляризации потенциалы электродов
одинаковы:
Два
серебрянных электрода помещены в раствор
AgNO3. Без наложения
внешней поляризации потенциалы электродов
одинаковы:
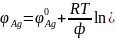 .
.
Процессы при электролизе:
(-) катод:
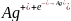
(+) анод:
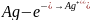
Концентрация
потенциалопределяющих ионов
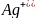 в
процессе электролиза у катода и анода
будет различаться: у катода она меньше
равновесной, у анода - больше. Возникает
концентрационный элемент, ЭДС которого
направлена навстречу внешней ЭДС. Такое
явления носит название концентрационный
поляризации.
в
процессе электролиза у катода и анода
будет различаться: у катода она меньше
равновесной, у анода - больше. Возникает
концентрационный элемент, ЭДС которого
направлена навстречу внешней ЭДС. Такое
явления носит название концентрационный
поляризации.
5.5) Практические приложение электролиза
Существуют три группы гальванопокрытий:
1) антикоррозийные (Zn, Cd);
2) защитно-декоративные (Ni, Cr, Ag, Au);
3) специальные (Cr, Rt, Pd, Sb и др.).
Три операции при нанесении покрытий: подготовка поверхности, электролиз, отделка осадка.
Подготовка включает в себя механические и химические операции: удаление оксидных плёнок и жировых загрязнений.
Электролитами являются растворы кислот, солей и щелочей; органические добавки входит для получения блестящих покрытий.
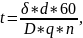 где
t - время,
- толщина осадка, d -
плотность осаждаемого металла.
где
t - время,
- толщина осадка, d -
плотность осаждаемого металла.
Операции отделки осадка включают в себя крацовку и глянцовку.
