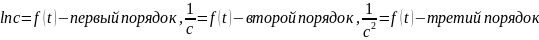- •5. Основы химической кинетики
- •1) Скорость гомогенных реакций
- •1.1)Закон действующих масс (з.Д.М.)
- •1.2) Молекулярность и порядок реакции
- •1.3) Интегрирование дифференциальных кинетических уравнений
- •1.4) Классификация реакций по степени сложности
- •1.5) Зависимость скорости реакции от температуры.
- •1.6) Принцип а. Ле-Шателье
- •2) Скорость гетерогенных реакций
- •2.1) Скорость растворение твердого тела в жидкости
- •3) Гомогенный и гетерогенный катализ
- •6. Растворы
- •1) Способы выражения концентрации растворов
- •2) Физические и химические процессы при растворении.
- •3.4) Закон распределения и коэффициент распределения
- •4) Законы ф.-м. Рауля. Эбулиоскопия и криоскопия
- •5) Растворы электролитов
- •5.1) Электролитическая диссоциация
- •5.2) Сильные и слабые электролиты. Степень диссоциации и константа диссоциации. Закон разведения Оствальда.
- •7) Гидролиз солей. Константа и степень гидролиза
- •10. Поверхностные явления
- •1) Адгезия, когезия, сорбция: адсорбция и абсорбция. Физическая адсорбция. Хемосорбция. Величина адсорбции
- •2) Механизм адсорбции
- •3) Термодинамика поверхностных явления
- •3.1) Поверхностное натяжение твёрдых тел. Принцип Гиббса-Кюри
- •3.2) Поверхностное натяжение растворов
- •4) Изотерма адсорбции Лэнгмюра, эмпирическое уравнение Фрейндлиха.
- •8. Основы электрохимии
- •1) Электродные потенциалы. Возникновение скачка потенциала на поверхности раздела "металл-раствор". Равновесны потенциал.
- •2) Теория гальванического элемента
- •2.1) Медно-цинковый элемент Якоби-Даниэля
- •2.2) Термодинамика гальванического элемента
- •3) Водородный показатель. Понятие о стандартных потенциалах. Ряд напряжений
- •4) Типы электродов и цепей
- •4.1) Окислительно-восстановительные электроды и цепи
- •5) Электролиз
- •5.1) Общие положения
- •5.2) Последовательность разряда ионов в водных растворах
- •5.3) Количественные законы электролиза (законы м. Фарадея). Удельный расход энергии
- •5.4) Поляризация. Напряжение разложения и перенапряжение
- •5.5) Практические приложение электролиза
- •6) Химические источники тока (хит)
- •6.1) Общие положения
- •6.2) Первичный хит - гальванические элементы
- •6.3) Вторичные хит-аккумуляторы
- •6.4) Топливные элементы
- •9. Коррозия металлов и методы борьбы с ней
- •1) Классификация процессов коррозии
- •2) Химическая коррозия (газовая и жидкостная)
- •3) Гальванокоррозия (микро- и макро)
- •4) Электрокоррозия
- •5) Атмосферная и почвенная коррозия
- •6) Методы борьбы с коррозией
Оглавление
5. Основы химической кинетики 3
1) Скорость гомогенных реакций 3
1.1)Закон действующих масс (з.д.м.) 3
1.2) Молекулярность и порядок реакции 3
1.3) Интегрирование дифференциальных кинетических уравнений 3
1.4) Классификация реакций по степени сложности 4
1.5) Зависимость скорости реакции от температуры. 5
1.6) Принцип А. Ле-Шателье 6
2) Скорость гетерогенных реакций 6
2.1) Скорость растворение твердого тела в жидкости 7
3) Гомогенный и гетерогенный катализ 7
6. Растворы 7
1) Способы выражения концентрации растворов 8
2) Физические и химические процессы при растворении. 8
3) Растворимость твёрдых веществ в жидкостях, жидкостей в жидкостях и газов в жидкостях 8
3.1) Растворимость твёрдых веществ в жидкостях 8
3.2) Растворимость жидкостей в жидкостях. 9
3.3) Растворимость газов в жидкостях. Закон В.Генри. Закон Д.Дальтона 9
3.4) Закон распределения и коэффициент распределения 10
4) Законы Ф.-М. Рауля. Эбулиоскопия и криоскопия 10
5) Растворы электролитов 10
5.1) Электролитическая диссоциация 10
5.2) Сильные и слабые электролиты. Степень диссоциации и константа диссоциации. Закон разведения Оствальда. 11
5.3) Состояние сильных электролитов в растворе 11
11
5.4) Произведение растворимости 11
6) Электролитическая диссоциация. Ионное произведение воды. Водородный показатель 12
6.1) Понятие об индикаторах 12
7) Гидролиз солей. Константа и степень гидролиза 12
10. Поверхностные явления 14
1) Адгезия, когезия, сорбция: адсорбция и абсорбция. Физическая адсорбция. Хемосорбция. Величина адсорбции 14
2) Механизм адсорбции 15
15
3) Термодинамика поверхностных явления 15
3.1) Поверхностное натяжение твёрдых тел. Принцип Гиббса-Кюри 15
3.2) Поверхностное натяжение растворов 15
4) Изотерма адсорбции Лэнгмюра, эмпирическое уравнение Фрейндлиха. 15
8. Основы электрохимии 16
1) Электродные потенциалы. Возникновение скачка потенциала на поверхности раздела "металл-раствор". Равновесны потенциал. 16
2) Теория гальванического элемента 17
2.1) Медно-цинковый элемент Якоби-Даниэля 17
2.2) Термодинамика гальванического элемента 18
3) Водородный показатель. Понятие о стандартных потенциалах. Ряд напряжений 19
4) Типы электродов и цепей 19
4.1) Окислительно-восстановительные электроды и цепи 20
20
5) Электролиз 20
21
5.1) Общие положения 21
5.2) Последовательность разряда ионов в водных растворах 21
5.3) Количественные законы электролиза (законы М. Фарадея). Удельный расход энергии 22
5.4) Поляризация. Напряжение разложения и перенапряжение 22
5.5) Практические приложение электролиза 23
6) Химические источники тока (ХИТ) 23
6.1) Общие положения 23
6.2) Первичный ХИТ - гальванические элементы 23
6.3) Вторичные ХИТ-аккумуляторы 23
6.4) Топливные элементы 24
9. Коррозия металлов и методы борьбы с ней 25
1) Классификация процессов коррозии 25
2) Химическая коррозия (газовая и жидкостная) 25
3) Гальванокоррозия (микро- и макро) 27
4) Электрокоррозия 28
5) Атмосферная и почвенная коррозия 28
6) Методы борьбы с коррозией 29
5. Основы химической кинетики
Кинетика - учение о скоростях химических реакций.
Количественно скорость химической реакции принято характеризовать изменением концентрации реагирующих веществ в единицу времени.
Концентрации
реагирующих веществ со временем убывают,
уменьшается и скорость реакции. Различают
среднюю скорость ( )
в интервале времени t1
- t2 и истинную
скорость (V) в момент
времени t :
)
в интервале времени t1
- t2 и истинную
скорость (V) в момент
времени t :
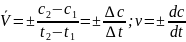
Знак "+" ставится в том случае, когда скорость определяется по увеличению концентрации продуктов реакции, "-" - по уменьшению концентрации исходных веществ. Скорость реакции является всегда величиной положительной.
Характер протекания гомогенных (однофазных) реакций отличается от характера протекания гетерогенных (многофазных) реакций.
Газовая реакция: N2 + 3H2 = 2NH3
реакция в растворе: HCl + NaOH = NaCl + H2O
Гомогенные реакции протекают сразу во всем объеме реагирующей смеси.
Гетерогенные реакции протекают на границе раздела фаз: Zn(т) + H2SO4(р-р) = ZnSO4(р-р) + H2(г)
1) Скорость гомогенных реакций
Чем больше концентрация, тем чаще происходят столкновения молекул.
1.1)Закон действующих масс (з.Д.М.)
При постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
A + B = D, v = k[A][B], где k - константа скорости реакции, зависящая от природы реагирующих веществ, в квадратных скобках - концентрации участников реакции.
Если положить
[A] = 1
 и [B] =
, то v = k,
следовательно, константа скорости
численно равна скорости реакции для
того случая, когда концентрации каждого
из реагирующих веществ равны единице.
и [B] =
, то v = k,
следовательно, константа скорости
численно равна скорости реакции для
того случая, когда концентрации каждого
из реагирующих веществ равны единице.
"k" не зависит от концентрации в каждый момент времени.
1.2) Молекулярность и порядок реакции
С точки зрения числа частиц, участвующих в реакции, последние классифицируют по признаку молекулярности или по признаку порядка.
Молекулярность реакции определяется по числу молекул, одновременное соударение которых приводят к химическому взаимодействию.
Одномолекулярная реакция: J2 = 2J
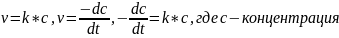
Двумолекулярная реакция:
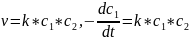
Трехмолекулярная реакция:
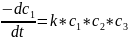
Порядок реакции равен сумме показателей степени у концентраций в уравнении, выражающем зависимость скорости реакции от концентрации реагирующих веществ.
1.3) Интегрирование дифференциальных кинетических уравнений
Реакция первого порядка
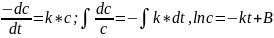
Константа
скорости
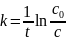 имеет размерность обратного времени,
т.е.
имеет размерность обратного времени,
т.е.
сек-1.
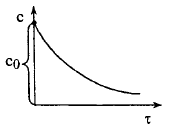 Из
выражения
Из
выражения
 следует, что концентрация стремится к
нулю при стремлении времени t
к бесконечности.
следует, что концентрация стремится к
нулю при стремлении времени t
к бесконечности.
Определим
период полураспада t1/2
- время, в течение которого начальная
концентрация уменьшается вдвое:
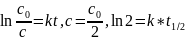
В выражение для периода полураспада реакции первого порядка начальная концентрация не входит.
Реакция второго порядка
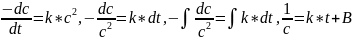
Размерность к[конц-1 * время-1]
Период
полураспада

Если начальные концентрации c0.1 и c0.2 исходных веществ неодинаковы, то, обозначив через х убыть концентрации x = c0 - c получаем:
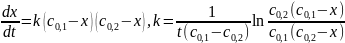
Реакция третьего порядка
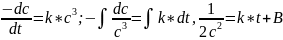
Размерность к[конц-1 * время-1]
Период
полураспада
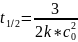
На практике порядок реакции определяется экспериментально, для чего строят три графика: