
lectiss Popovoy PH
.pdf
3) Определение рН растворов – необходимо составить цепь из индикаторного
(водородный, хингидронный или стеклянный) электрода, заполненного исследуемым
электродом, и электродом сравнения (каломельный или хлорсеребряный):
+
а) Pt | H2 ( pH2 |
1атм | H (pH ?) || KClнас | Hg2Cl2 | Hg | Pt |
|||||||||||||||||||
|
|
|
|
pH |
|
|
|
E Eкал |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
0,059 |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
б) Pt | Hg | Hg Cl |
2 |
| KCl(0,1M) || C |
H |
O |
2 |
,C H |
4 |
OH |
2 |
,H (pH ?) | Pt |
||||||||||
2 |
|
6 |
4 |
|
|
|
|
6 |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
Eо |
E |
|
E |
|
|
|
||||||
|
|
|
pH |
|
|
|
|
|
хг |
|
|
кал |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
0,059 |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
в) Pt | Ag | AgCl | KCl || рН |
? |стекло | HCl(0,1M) | AgCl | Ag | Pt |
|||||||||||||||||||
|
|
|
|
|
|
E |
о |
|
E |
|
|
, AgCl / Ag |
E |
|||||||
|
|
|
рН |
|
cт |
Cl |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
0, 059 |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
4) Определение константы диссоциации слабого электролита:
= − |
, |
= → = |
|
→ |
= |
|
|
1 − |
5) Определение произведения растворимости – могут быть использованы различные электрохимические цепи, например: составляется цепь без переноса, справа – электрод 1-го рода, обратимый по катиону малорастворимого соединения, слева - электрод 2-ого рода,
обратимый по аниону того же малорастворимого соединения.
|
|
| | |
|| | |
||||||
Eo |
|
|
Eo |
|
|
|
|
RT |
ln Ks, AgCl , |
/ Ag |
,AgCl / Ag |
|
|||||||
Ag |
|
Cl |
|
|
F |
||||
тогда
, = |
( − ) |
|
4

6) Определение активностей и коэффициентов активности – используется электрохимическая цепь без переноса, один из электродов которой обратим по катиону,
другой – по аниону.
Пусть требуется определить активность и средний ионный коэффициент активности
сильного электролита MQ AQ . Для этого составим гальванический элемент из электродов 1-
го и 2-го рода, обратимых соответственно по катиону Mz и аниону Az и погруженных в раствор электролита заданной концентрации m:
Pt | M | MQ AQ (Mz ,Az ) (m, моль / кг) | McQ AQ | Mc| Pt
Принимая во внимание, что активности чистых фаз aM 1, aMc 1 и aMlQ AQ |
1, |
получаем следующее выражение для ЭДС элемента:
|
|
|
|
|
|
|
||
= |
− |
|
|
|
= |
− |
|
|
Индивидуальные активности ионов, средние ионные активности, активность и моляльность электролита MQ AQ связаны уравнениями:
aMQ+ AQ |
aMQ z aAQ z arQ(MQ AQ ) , |
ar mrJr QrmJr
5

Лекция 8
ФОРМАЛЬНАЯ КИНЕТИКА
Химическая термодинамика отвечает на вопрос о принципиальной возможности и направлении химического процесса и устанавливает возможный его результат, но не
занимается рассмотрением скорости и механизма превращения.
Так, ряд процессов, возможных с точки зрения термодинамики, не протекает в реальных условиях. Например, образование воды при взаимодействии водорода и кислорода не происходит в стандартных условиях при 298 К, несмотря на термодинамическую
возможность протекания данного процесса ( |
|
° |
|
). То есть при изучении |
|
химических превращений недостаточно |
только термодинамического подхода, поскольку |
||||
|
∆ |
|
= −230 кДж/моль |
|
|
принципиальная термодинамическая возможность протекания ряда процессов может быть не реализована из-за очень малых скоростей реакций.
Изучением закономерностей физико-химических превращений во времени и занимается химическая кинетика.
Химическая кинетика – наука, занимающаяся изучением скоростей химических превращений, факторов, определяющих эти скорости, а также механизмов протекающих реакций.
Раздел химической кинетики, занимающийся формальным количественным описанием химических превращений на основании экспериментальных данных без рассмотрения механизма протекающего процесса, называется формальной кинетикой.
Основные понятия и определения
В ходе реакции количество исходных веществ уменьшается, а продуктов реакции – увеличивается. Зависимость концентрации участников химической реакции от времени протекания изображают в виде кинетических кривых.
Для реакции вида → , где А – исходное вещество, а В – продукт реакции:
1

Скорость реакции ( ) – изменение количества вещества ( ) в единицу времени ( ) в
единице объема ( ):
1
= ±
Если реакция протекает при постоянном объеме, то скорость реакции определяется изменением концентрации вещества ( ) в единицу времени:
= ±
Если в вышеприведенном уравнении скорость реакции определяется по изменению концентрации исходного реагента, то перед производной ставится знак «−», если скорость
-реакции определяется по изменению концентрации продукта, то знак «+».
Скорость реакции может быть определена по экспериментальным данным, как средняя величина по разности концентраций в разные моменты времени:
−
= ±
−
Рассчитанная таким образом скорость является неизменной в соответствующем временном промежутке и называется средней скоростью реакции.
Истинная или мгновенная скорость реакции, то есть скорость в данный конкретный момент времени (t’), определяется как тангенс угла наклона касательной (β) к кинетической кривой:
=
Стечением времени скорость реакции уменьшается, что видно из приведенных графиков.
Размерность скорости связана с размерностью концентрации. Обычно это
моль/(л·время). В кинетике единицы измерения времени могут быть любыми (с, мин, год и
т.д.).
2

Еще одной характеристикой протекания реакции во времени является период полупревращения ⁄ – время, за которое начальная концентрация исходного вещества уменьшиться вдвое.
Скорость реакции может быть выражена через концентрацию любого участника реакции – как исходного вещества, так и продукта реакции. Так, для реакции:
как любая из производных |
, , , |
. В этом случае |
скорость может быть определена + = + |
скорость будет зависеть от выбора реагента.
Изменения концентраций каждого из реагентов не являются независимыми, а связаны между собой стехиометрическими соотношениями. Соответственно, для определения инвариантной, то есть независящей от выбора реагента скорости реакции, учитываются
стехиометрические коэффициенты уравнения: |
1 |
1 |
|||
1 |
1 |
|
|||
= − = − |
|
= |
|
= |
|
При постоянной температуре скорость реакции зависит от концентрации реагирующих веществ. Чем больше концентрация веществ, вступающих в реакцию, тем выше скорость.
Математическая формула, связывающая скорость реакции с концентрацией реагентов,
называется кинетическим уравнением, которое выражает основной постулат химической кинетики – так называемый закон действующих масс:
Скорость реакции в каждый момент времени пропорциональна произведению концентрации реагирующих веществ, возведенных в некоторые степени.
Для реакции
+ = +
кинетическое уравнение имеет следующий вид:
=
Коэффициент пропорциональности в этом уравнении носит название константы скорости химической реакции. Физический смысл этой величины, иногда называемой удельной скоростью реакции, заключается в следующем: константа скорости численно равна скорости реакции при единичной концентрации реагирующих веществ.
Константа скорости не зависит от концентрации реагирующих веществ, определяется природой←реакции и зависит от температуры, а также от условий протекания процесса
(наличия катализатора, природы растворителя и т.д.).
Размерность константы скорости зависит от вида кинетического уравнения.
3

Показатель степени при концентрации в кинетическом уравнении называется
порядком реакции. При этом в приведенном примере называется частным порядком по компоненту А, а – частным порядком по компоненту В. Сумма частных порядков определяет полный порядок реакции: = + .
Порядок реакции является величиной формальной, физического смысла не имеет,
определяется экспериментально.
Для простых реакций порядок совпадает со стехиометрическим коэффициентом, то есть = , = . (Простыми называются реакции, протекающие в одну стадию,
механизм которых правильно отражается стехиометрическим уравнением.)
В общем случае, когда механизм реакции включает в себя несколько элементарных стадий, ≠ , ≠ .
Порядок реакции может принимать любые значения – целочисленные и дробные, а
также может быть равен нулю. По величине порядка реакции делятся на реакции первого,
второго, третьего и т.д. порядков.
Еще один вид классификации реакций – по молекулярности.
Молекулярность – число частиц, участвующих в элементарном акте химического взаимодействия. Молекулярность может принимать значения 1, 2 и 3. Более высокие значения молекулярности маловероятны, так как это означало бы одновременное столкновение четырех и более частиц.
По этому признаку реакции делятся на мономолекулярные, бимолекулярные и тримолекулярные. В простых реакциях значения молекулярности и порядка совпадают. В
случае многостадийного процесса можно говорить лишь о молекулярности элементарной стадии.
Метод изолирования Оствальда
В случае, когда в реакции участвуют несколько веществ, и некоторые из них взяты в избытке, так что в ходе реакции их концентрация меняется незначительно, имеет место понижение порядка по сравнению с молекулярностью.
Например, для реакции + = + кинетическое уравнение имеет вид:
=
Если провести эту реакцию в избытке вещества В, так что ≈ на протяжении всего процесса, то скорость реакции можно записать следующим образом:
=
4

где - некая эффективная константа скорости, включающая в себя неизменную концентрацию вещества В. В этом случае экспериментально определенный порядок реакции будет равен частному порядку по компоненту А.
Если затем провести эту же реакцию в избытке вещества А. то экспериментально определенный порядок реакции будет равен частному порядку по компоненту В.
=
Данный приём называется методом изолирования Оствальда и позволяет экспериментально найти частные порядки реакции по отдельным компонентам.
Кинетика простых необратимых реакции
Вывод интегральных кинетических уравнений для реакций различных порядков осуществляется на основании выражения:
− =
где – порядок реакции.
Реакции первого порядка
В реакцию вступает одно вещество:
→ продукты
Креакциям первого порядка относятся такие процессы как термическое разложение,
реакции изомеризации, радиоактивный распад, ряд бимолекулярных реакций при избытке одного из реагентов.
Дифференциальная форма кинетического уравнения:
− =
Путем интегрирования в пределах от 0 до и, соответственно, от до получаем для константы скорости:
=
или
=
−
где – концентрация реагирующего вещества в момент времени = 0, – концентрация в данный момент времени, – убыль концентрации к данному моменту времени.
5
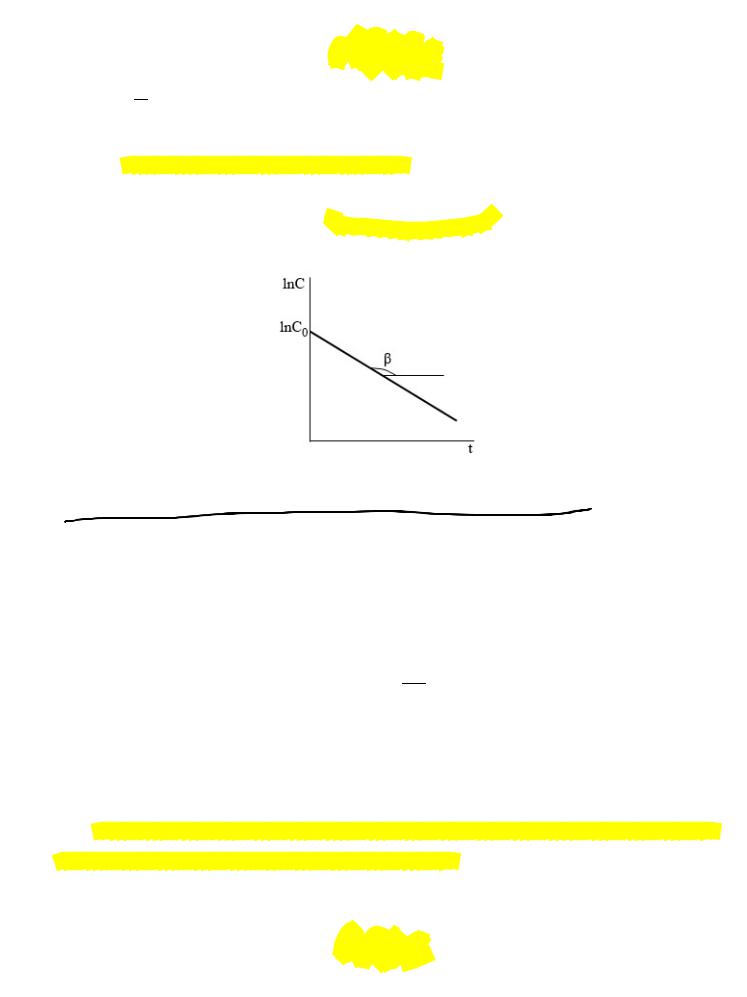
Выражение константы скорости через степень диссоциации α:
11
=
1 −
где = – отношение убыли концентрации реагирующего вещества к начальной
концентрации.
Размерность константы скорости − [время-1]
Переписав выражение для константы скорости в виде:
= − +
получаем уравнение линейной зависимости:
Тангенс угла наклона прямой равен константе скорости реакции: = −
-
Зависимость концентрации реагирующего вещества в реакции первого порядка экспоненциальная:
=
Период полупревращения в реакции первого порядка не зависит от начальной концентрации реагирующего вещества:
2
⁄ =
Реакции второго порядка
Реакции второго порядка – это реакции вида:
2 → продукты или + → продукты
К реакциям первого порядка относятся такие процессы как реакции димеризации, ряд гидоролитических реакций в щелочных растворах и т.д.
Дифференциальная форма кинетического уравнения в случае участия в реакции молекул одного вещества или равенства концентрации двух реагирующих веществ:
− =
6
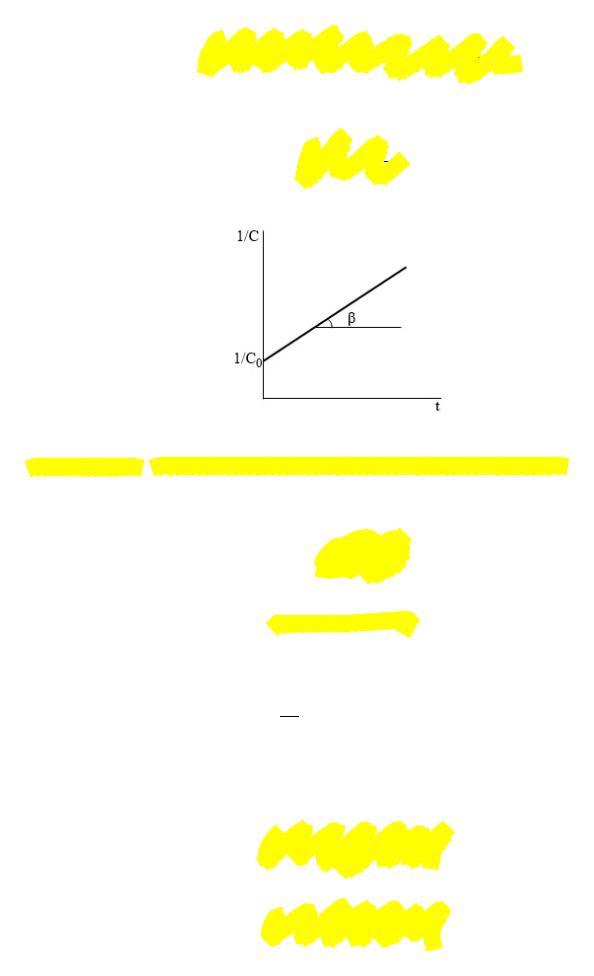
Путем интегрирования в пределах от 0 до |
|
и, соответственно, от |
|
до |
|
получаем для |
||||||||
константы скорости: |
1 |
|
1 |
|
1 |
|
|
|
|
|
|
|||
1 |
− |
|
|
∙ |
|
|
|
|
|
|
||||
= |
|
или |
-= |
-1 |
|
) |
|
|
|
|
||||
скорости − [л·моль |
1 |
·время |
] |
|
|
|
|
|||||||
Размерность константы |
|
|
|
|
|
|
|
( − |
|
|
|
|
||
Переписав выражение для константы скорости в виде:
11
=+
получаем уравнение линейной зависимости:
Тангенс угла наклона прямой равен константе скорости реакции: =
Период полупревращения в реакции второго порядка обратно пропорционален начальной концентрации реагирующего вещества:
1
⁄ =
Для реакции типа
+ → продукты
при разных начальных концентрациях реагирующих веществ дифференциальная форма кинетического уравнения:
= ( − )( − )
где – начальная концентрация вещества А, – начальная концентрация вещества В, –
убыль концентрации реагирующих веществ к данному моменту времени.
После интегрирования получаем:
1( − )
= ( − ) ( − )
Период полупревращения:
⁄ |
1 |
|
= ( − ) |
2 − |
7
Лекция 9
Реакции третьего порядка
Реакции второго порядка – это реакции вида:
3 → продукты, 2 + → продукты или + + → продукты
Пример реакций третьего порядке – взаимодействие оксида азота (II) с галогенами:
2 + = 2
Дифференциальная форма кинетического уравнения в случае равенства концентрации реагирующих веществ:
− =
Путем интегрирования в пределах от 0 до и, соответственно, от до получаем для константы скорости:
1 |
1 |
1 |
= |
|
− |
2 |
|
Размерность константы скорости − [л2·моль-2·время-1]
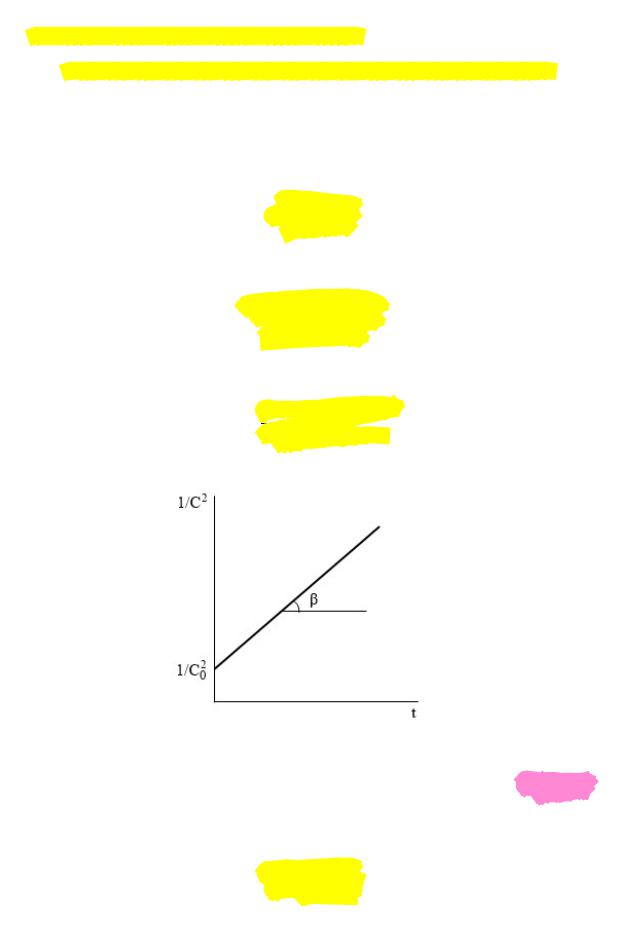
Переписав выражение для константы скорости в виде:
11
=2 +
получаем уравнение линейной зависимости:
По тангенсу угла наклона прямой можно найти константу скорости реакции: |
|
|
Период полупревращения в реакции третьего порядка обратно |
пропорционален |
|
= |
|
|
квадрату начальной концентрации реагирующего вещества:
3
⁄ =
2
1
