
lectiss Popovoy PH
.pdf
1
= − 2
В теории активных соударений под энергией активации понимают минимально необходимую энергию, которой должна обладать молекула в момент соударения, чтобы прореагировать. Более строго, в рамках молекулярно-кинетической теории энергию активации можно оценить, как разность между средней энергией активных молекул и средней энергией всех молекул.
Анализ экспериментальных данных показывает, что для реакций атомов и некоторых реакций простых молекул и радикалов предэкспоненциальные факторы в пределах порядка величины совпадают со значениями, предсказываемыми теорией соударений.
Однако для более сложных радикалов и молекул экспериментальные значения k0
-
существенно меньше, чем это следует из теории соударений.
Чтобы согласовать формулу теории с экспериментальными данными, в нее вводят
стерический фактор р, которым учитывается тот факт, что для осуществления реакции частицы в момент столкновения должны быть должным образом ориентированы друг относительно друга:
= ∙ ∙
Достоинства и недостатки теории активных соударений
Достоинства:
xтеория раскрыла механизм активации молекул;
xтеория дала формулу, обосновывающую уравнение Аррениуса;
xтеория дала подход к расчету предэкспоненциального множителя.
Недостатки:
xнеобходимость введения стерического множителя;
xтеория не дает путей расчета энергии активации, используя экспериментальную.
Мономолекулярные реакции. Схема Линдемана
Мономолекулярные реакции – это простейший тип элементарной реакции, в
которой молекула исходного вещества превращается в продукты.
Мономолекулярному распаду, как правило, подвергаются сложные молекулы,
состоящие из большого числа атомов.
Рассмотрим монолекулярную реакцию
→ продукты
Согласно Линдеману схема механизма реакции включает следующие стадии:
4

1.Стадия активации
+ → +
Активация молекул происходит путем двойных соударений.
– активные молекулы – такие молекулы, которые обладают энергией равной или большей некоторой минимальной величины, достаточной для превращения исходной молекулы в продукты реакции.
Вто время как в бимолекулярной реакции вслед за активацией молекул немедленно следует реакция между ними, в мономолекулярных реакциях активные молекулы после соударения существуют некоторое время, не распадаясь. В этих молекулах происходит перераспределение энергии между различными связями.
Втечение этого промежутка времени активированная молекула может или превратиться в продукты или, столкнувшись с другой молекулой, потерять свою активность.
2. Стадия дезактивации
+ → +
3. Стадия превращения активных молекул в продукты реакции
→ продукты
Наблюдаемая скорость реакции равна скорости третьей стадии, которая является лимитирующей.
= [ ]
Активированную молекулу можно считать неустойчивым промежуточным соединением, к которому применим принцип стационарных концентраций. То есть активированная частица образуется и расходуется с одинаковой скоростью, поэтому ее концентрация не изменяется со временем.
[ ]
= обр − расх = 0
Активированная молекула образуется в первой стадии и расходуется во второй и третьей стадиях:
[ ]
= [ ] − [ ][ ] − [ ]
Выражаем концентрацию активированных молекул:
[ ]
[ ] =
[ ] +
Подставляя найденную концентрацию активированной молекулы в уравнение скорости
реакции:
5

[ ]
= [ ] =
[ ] +
Из полученного уравнения следует, что мономолекулярная реакция вещества А имеет
порядок промежуточный между первым и вторым.
Рассмотрим предельные случаи:
1)Давление (концентрация) вещества А велико
Вэтом случае скорость стадии дезактивации может оказаться намного больше стадии превращения активированной частицы в продукты.
[ ]
= |
[ ] |
= |
|
[ ] |
[ ] |
|
Уравнение совпадает с уравнением скорости первого порядка.
2)Давление (концентрация) вещества А мало
Вэтом случае скорость третьей стадии может оказаться больше скорости второй стадии.
[ ]
[ ]
= |
|
= [ ] |
|
||
|
|
|
Уравнение является уравнением скорости реакции второго порядка.
В процессах активации и дезактивации в качестве второй частицы, отдающей энергию молекуле А или отнимающей у нее энергию, могут выступать любые инертные для этой реакции молекулы. Поэтому опытно наблюдаемая скорость реакции зависит от полного давления в системе, а не только от парциального давления вещества А.
6
Лекция 13
Теория активированного комплекса (переходного состояния)
Основная идея теории состоит в том, что в ходе любой химической реакции начальная конфигурация атомов переходит в конечную путем непрерывного изменения межъядерных расстояний. При этом всегда существует некоторая промежуточная конфигурация атомов, в
которой связь А-В уже ослаблена, но не полностью разорвана, а связь В-С уже начала образовываться. Такая конфигурация является критической для данной реакции. Если система ее достигла, то имеется возможность того, что реакция будет завершена.
+ → ( ) → +
При изменении межатомных расстояний изменяется потенциальная энергия системы.
Расположение атомов в молекуле реагентов всегда отвечает некоторому минимуму потенциальной энергии системы. Чтобы произошел акт химической реакции, атомы должны сместиться, на что чаще всего необходимо затратить энергию.
В какой-то период, соответствующий началу взаимодействия реагентов (или началу перегруппировки атомов для мономолекулярной реакции), энергия системы увеличивается.
Увеличение общей энергии происходит для того, чтобы реагенты вступили в химическую реакцию. При этом система преодолевает барьер на поверхности потенциальной энергии,
отделяющий реагенты от продуктов реакции.
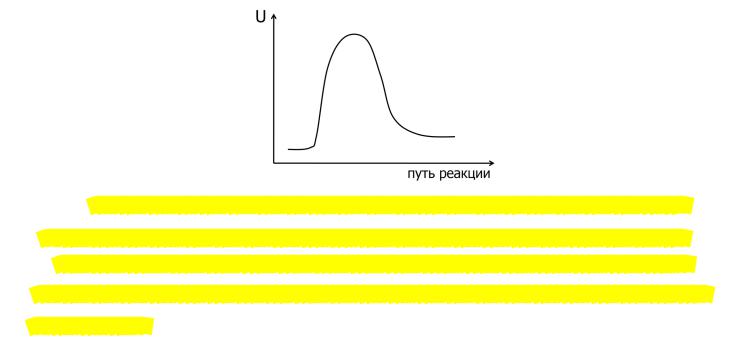
Потенциальный барьер – максимум потенциальной энергии, через который должна пройти система в ходе элементарного акта химического превращения. В ходе реакции вещества переходят в неустойчивое промежуточное состояние, характеризующееся большим запасом энергии. Это состояние называется активированным комплексом или переходным состоянием. Именно для его образования необходима энергия активации. Число частиц,
входящих в активированный (переходное состояние системы) комплекс, определяет молекулярность данной стадии реакции. Разницу в максимальной энергии системы и энергии исходного или конечного состояния называют энергией активации прямой или обратной реакции.
1

Рассмотрим простейший случай, когда все три атома (А, В и С) располагаются на одной прямой.
В этом случае потенциальная энергия системы будет зависеть только от двух
переменных r1 (межъядерное расстояние в молекуле АВ) и r2 (межъядерное расстояние в молекуле ВС), поскольку r3 = r1 + r2. Поверхность потенциальной энергии будет
в этом случае трехмерной. Если построить эту поверхность U (r1 , r2 ) в декартовой системе координат (r1 , r2 ,U ) и затем спроецировать на плоскость r1 , r2 линии пересечения поверхности
U (r1 , r2 ) с различными плоскостями, параллельными плоскости r1 , r2 , то получится топографическая карта поверхности потенциальной энергии.
«Долина» в правом нижнем углу отвечает исходным веществам (долина исходных веществ). «Долина» в левом верхнем углу отвечает конечным продуктам (долина продуктов).
Пунктирной линией показан энергетически наиболее выгодный путь движения системы из начального состояния в конечное. Этот путь называют координатой реакции.
Крестиком отмечена точка перевала, отвечающая наибольшей потенциальной энергии,
÷
преодолеваемой при движении по координате реакции, т.е. переходному состоянию или
активированному комплексу.
Таким образом, координата реакции – изменение совокупности межъядерных расстояний при переходе от начальной конфигурации к конечной, сопровождающееся минимальным изменением потенциальной энергии.
Изменение потенциальной энергии системы соответствует ее движению вдоль координаты реакции.
2

Истинной энергией активации элементарного химического акта называется минимальная энергия, которой должна обладать исходная система сверх своей нулевой энергии (при 0 К), чтобы в ней могли произойти химические превращения. Разность истинной энергии активации обратной и прямой реакций равна тепловому эффекту реакции при абсолютном нуле.
Энергия Eo при T = 0 не равна точно экспериментальной энергии активации Ea при
T z 0. Это вызвано тем, что в реальных условиях при T z 0 в элементарных актах участвуют молекулы с различными энергиями. Экспериментальная энергия активации отражает результат усреднения по всем элементарным актам с учетом функции распределения по энергиям.
Особенности переходного состояния
Переходное состояние неустойчиво в отношении движения вдоль координаты реакции,
так как оно отвечает максимуму, а не минимуму потенциальной энергии. В отношении движений в любом другом направлении переходное состояние устойчиво, так как потенциальная энергия системы при таких движениях возрастает.
Движение вдоль координаты реакции можно рассматривать как одномерное поступательное движение, по крайней мере на коротком прямолинейном участке на вершине барьера. Поэтому активированный комплекс можно рассматривать как обычную молекулу, у
которой одна колебательная степень свободы заменена на степень свободы поступательного движения вдоль координаты реакции.
Таким образом, в реакцию могут вступать только такие молекулы, которые обладают энергией, равной или превышающей некоторую критическую для данной реакции величину.
Такие молекулы называют активированными.
Как отмечено выше, активированный комплекс является критическим состоянием реагирующей системы, из которого она переходит в продукты реакции. Это критическое
3

состояние отвечает наивысшей точке на поверхности потенциальной энергии системы при движении системы из области (долины) исходных веществ в область (долину) продуктов по энергетически наиболее выгодному пути (координате реакции).
Теория активированного комплекса, как и теория столкновений, основана на предположении, что химическая реакция не нарушает равновесного распределения по энергиям для всех частиц, присутствующих в системе, включая активированный комплекс.
Это предположение позволяет существенно упростить математическую формулировку теории, поскольку для вычисления концентрации активированных комплексов можно использовать простые соотношения статистической термодинамики.
Уравнение теории активированного комплекса (переходного состояния)
В теории активированного комплекса элементарную реакцию представляют как мономолекулярный распад активированного комплекса в продукты реакции.
+ ( ) → +
Предполагается, что между реагентами и активированным комплексом существует квазиравновесие. Константу скорости мономолекулярного распада рассчитывают методами статистической термодинамики, представляя распад как одномерное поступательное движение комплекса по координате реакции.
Основное уравнение теории активированного комплекса, называемое также уравнением Эйринга, имеет вид:
= Б
kБ = 1.38.10-23 Дж/К - постоянная Больцмана, h = 6.63.10-34 Дж∙с - постоянная Планка,
- константа равновесия образования активированного комплекса, выраженная через молярные концентрации (в моль/л).
Чтобы учесть вероятность того, что не каждый активированный комплекс переходит через вершину потенциального барьера, в уравнение вводится трансмиссионный коэффициент.
= Б
Для подавляющего большинства реакций = 1.
В зависимости от того, как оценивают константу равновесия, различают статистический и термодинамический аспекты теории активированного комплекса
В статистическом подходе константу равновесия выражают через суммы по
-
состояниям:
4
= |
Б |
∙ |
|
∙ |
∏ реаг.
где - полная сумма по состояниям активированного комплекса, Qреаг - произведение полных сумм по состояниям реагентов, E - энергия активации при абсолютном нуле, T = 0.
Полные суммы по состояниям обычно разлагают на сомножители, соответствующие отдельным видам движения молекул: поступательному, электронному, вращательному и колебательному: Q = Qпост. Qэл.. Qвр.. Qкол.
В термодинамическом подходе константу равновесия выражают через разность
-
термодинамических функций активированного комплекса и исходных веществ. Для этого константу равновесия, выраженную через концентрации, переводят в термодинамическую константу равновесия.
|
= |
Б |
= |
Б |
|
|
∆ |
||||||
|
– изменение |
числа молекул при образовании активированного комплекса. |
|||||||||||
∆ = 1 − |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
х – молекулярность реакции. |
|
|
|
|
|
|
|
|
|
||||
С учетом этого получим: |
|
= |
Б |
|
|
|
|
|
|||||
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
||||
Учитывая, что |
|
|
|
|
|
|
|
|
|
|
|||
∆
=
∆ = ∆ − ∆
получим уравнение:
|
Б |
|
|
|
|
|
∆ |
|
Б |
|
|
|
|
|
∆ |
|
∆ |
|
|
|
|
∙ |
|
= |
|
|
|
∙ |
|
∙ |
|
||||
= |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
∆ , 'S z - изменение энтальпии и энтропии при переходе от исходных молекул к активированному комплексу.
Для сопоставления полученного уравнения для константы скорости с опытными данными энтальпию активации следует заменить опытной энергией активации.
|
∆ = |
− |
|
|
||||||||
|
Б |
|
|
|
|
|
∙ |
|
∙ |
∆ |
∙ |
|
|
|
|
|
|
|
|
||||||
= |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||
Сопоставление выражений для константы скорости по уравнениям Аррениуса, теории активных соударений и теории активированного комплекса показывает, что величина
|
Б |
|
совпадает по порядку величин с фактором соударений z0., следовательно |
|
5

∆
множитель приобретает смысл стерического множителя р, формально вводимого теорией активных соударений. Таким образом, теория активированного комплекса долаL
объяснение физического смысла стерического множителя, как вероятностного фактора.
6

Лекция 14
ФОТОХИМИЧЕСКИЕ РЕАКЦИИ
Если энергия квантов падающего света соответствует частоте электронного спектра поглощения реагирующей молекулы, то может произойти поглощение этого кванта. При этом образуется электронно-возбужденная молекула A*:
A hQ ko o A * .
Переход молекулы A в электронно-возбужденное состояние A* резко увеличивает ее
реакционную способность.
Передача энергии для активации вступающих во взаимодействие молекул может осуществляться либо в форме теплоты, либо в виде квантов электромагнитного излучения.
Реакции, в которых активация частиц реагирующих веществ является результатом их взаимодействия с квантами электромагнитного излучения видимой области спектра,
называют фотохимическими реакциями.
При всех фотохимических процессах выполняется закон Гротгуса:
Химическое превращение вещества может вызвать только то излучение, которое
поглощается этим веществом.
Излучение, отражённое веществом, а также прошедшее сквозь него, не вызывают никаких химических превращений. Иногда фотохимические процессы происходят под действием излучения, которое не поглощается реагирующими веществами; в таких случаях реакционная смесь должна содержать т.н. сенсибилизаторы. Механизм действия сенсибилизаторов заключается в том, что они поглощают свет, переходя в возбуждённое состояние, а затем при столкновении с молекулами реагентов передают им избыток своей энергии. Сенсибилизатором фотохимических реакций является, например, хлорофилл.
Фотохимическую реакцию можно разделить на три основные стадии: начальный акт поглощения, первичные фотохимические реакции и вторичные реакции.
Взаимодействие света с веществом может идти по трём возможным направлениям: 1. Возбуждение частиц (переход электронов на вышележащие орбитали):
A + hν ––> A*
2. Ионизация частиц за счет отрыва электронов:
A + hν ––> A+ + e–
3. Диссоциация молекул с образованием свободных радикалов (гомолитическая) либо ионов
(гетеролитическая):
AB + hν ––> A• + B•
AB + hν ––> A+ + B–
1
