
lectiss Popovoy PH
.pdf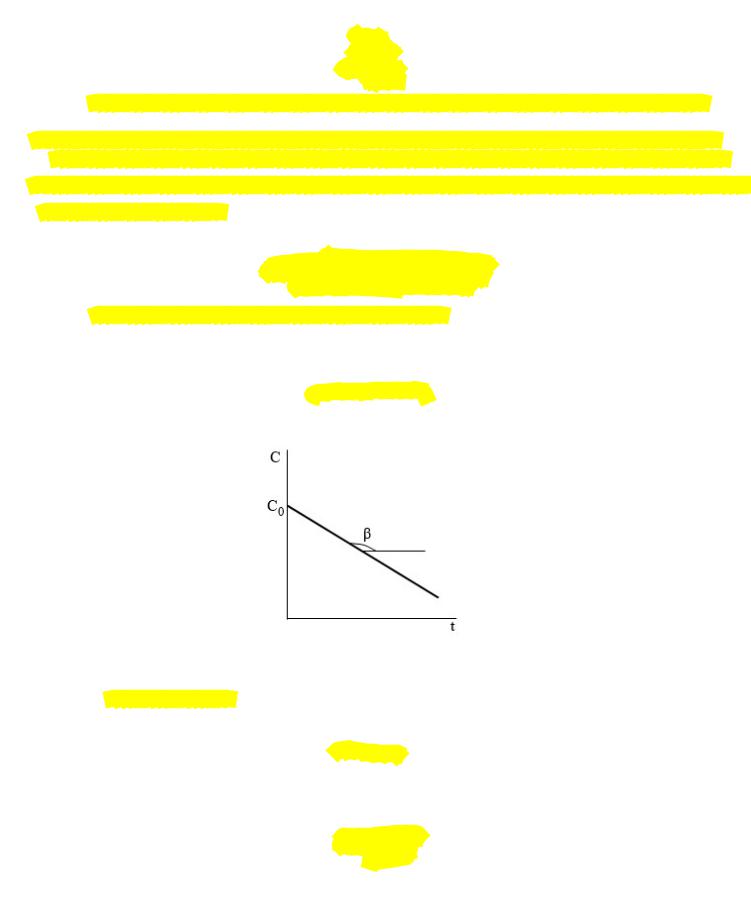
Реакции нулевого порядка
В ряде случаев при определенных условиях проведения процесса, экспериментально определяемый порядок реакции может оказаться равным нулю.
В этом случае дифференциальная форма кинетического уравнения будет иметь следующий вид:
− =
То есть скорость реакции равна константе и не зависит от времени. Примерами реакций нулевого порядка могут служить реакции в насыщенном растворе, находящемся в контакте с избытком нерастворенного реагирующего вещества или гетерогенные каталитические реакции, протекающие на поверхности твердого катализатора при непрерывном подводе реагентов в зону реакции.
Интегральное кинетическое уравнение константы скорости имеет вид:
1 |
− ) |
или = |
|
= ( |
|
Размерность константы скорости − [моль·л·время-1]
Изменение концентрации реагирующего вещества во времени описывается линейной зависимостью:
= − +
получаем уравнение линейной зависимости:
Тангенс угла наклона прямой равен одновременно скорости и константе скорости реакции: = = −
Концентрация продукта реакции линейно увеличивается со временем:
=
Период полупревращения в реакции нулевого порядка прямо пропорционален начальной концентрации реагирующего вещества:
⁄ =
2
2
МЕТОДЫ ОПРЕДЕЛЕНИЯ ПОРЯДКА РЕАКЦИИ
Методы определения порядка реакции делятся на интегральные и дифференциальные.
Интегральные методы основаны на использовании интегральных форм кинетического уравнения, дифференциальные методы основаны на дифференциальной форме кинетического уравнения. Все методы имеют аналитический и графический варианты.
Интегральные методы
1. Метод подстановки или подбора уравнения
а) Аналитический вариант.
Суть метода состоит в подстановке в уравнения для расчета константы скорости реакций разных порядков – первого, второго и третьего экспериментальных данных о концентрации реагирующих веществ в разные моменты времени. Порядок реакции считается выбранным верно, если рассчитанные по соответствующему уравнению значения констант скорости колеблются возле какой-то средней величины, и отклонения от среднего не превышают погрешности измерения.
б) Графический вариант.
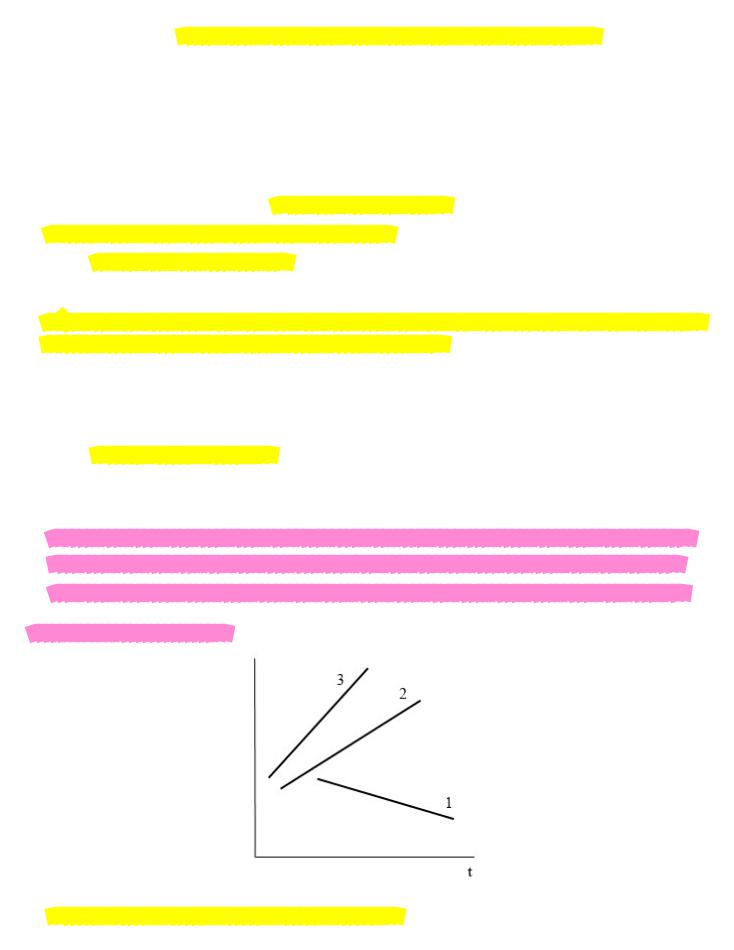
Суть метода состоит в нахождении такой функции концентрации от времени, которая имела бы линейный характер. Для каждого порядка зависимость концентрации от времени может быть выражена прямой линией, если правильно выбрать систему координат. Так для реакций
первого порядка прямая получается в системе координат |
|
(прямая 1), для второго |
|||||
порядка – в системе координат |
|
|
(прямая 2) , для |
третьего порядка – в координатах |
|||
1 |
− |
|
− |
|
|||
1 − |
(прямая 3). |
|
|
|
|
||
|
|
|
|
|
|
|
|
2. Метод определения времени полупревращения
Метод заключается в выявлении зависимости периода полупревращения от начальной концентрации реагирующего вещества. Так, для реакций первого порядка время
3
полупревращения не зависит от начальной концентрации, для реакций второго порядка оно обратно пропорционально начальной концентрации, для реакций третьего порядка оно обратно пропорционально квадрату начальной концентрации.
Все выше перечисленные методы применимы лишь к простым реакциям и позволяют скорее подтвердить предполагаемый порядок реакции, нежели рассчитать его.
3. Метод Оствальда-Нойеса
Метод позволяет непосредственно рассчитать порядок реакции на основании зависимости периода полупревращения (или времени достижения любой другой степени превращения) от начальной концентрации реагирующих веществ.
Для реакции n-го порядка период полупревращения равен
⁄ |
2 − 1 |
|
= ( − 1) |
= |
Таким образом, если известны хотя бы два значения периода полупревращения при двух разных начальных концентрациях, порядок реакции можно рассчитать по следующей формуле:
|
|
= |
|
− |
+ 1 |
|
|
|
|
|
|
|
− |
|
|
|
|
||
где , |
|
− начальная концентрация и |
|
|
и |
|
− |
||
|
|
|
время полупревращения в первом опыте, а |
|
|
|
|
||
|
|
|
|
|
|
||||
начальная концентрация и время полупревращения во втором опыте. |
|
|
|
|
|||||
|
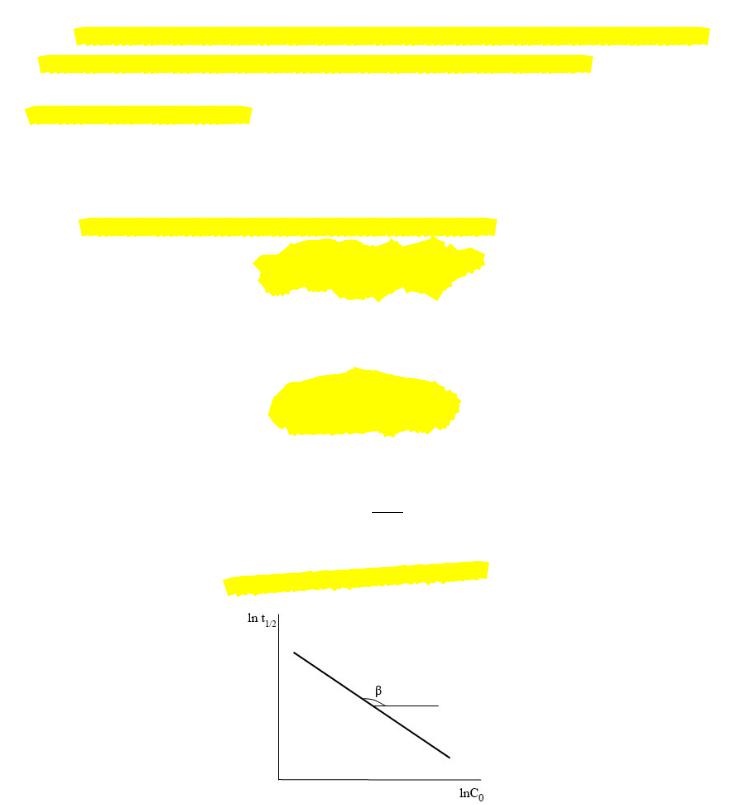
Прологарифмировав выражение |
⁄ |
= |
, можно получить уравнение прямой, не |
|||||
проходящей через начало координат: |
|
|
|
|
|
||||
= −( − 1) +
Тогда порядок реакции можно найти по тангенсу угла наклона прямой на графике:
= −( − 1)
4
Дифференциальный метод Вант-Гоффа
Дифференциальный метод Вант-Гоффа позволяет рассчитать любые порядки реакции на основании зависимости скорости реакции от концентрации реагирующих веществ.
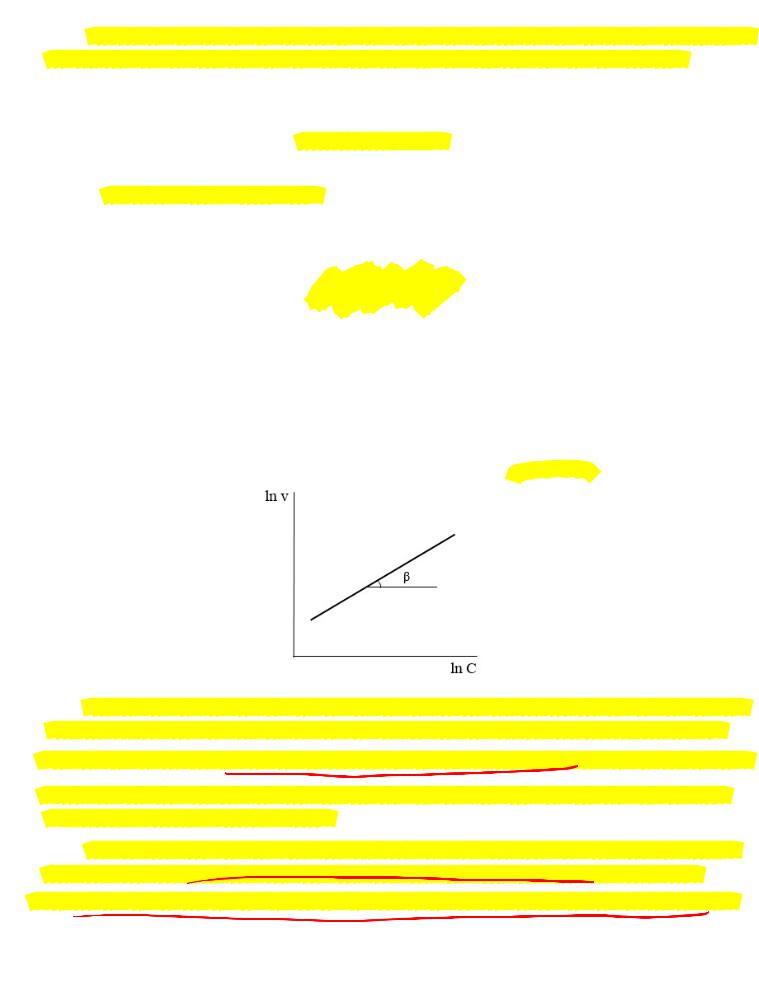
Основан на дифференциальном кинетическом уравнении = .
Прологарифмировав это выражение получаем:
= +
Далее расчет порядка реакции возможен аналитическим и графическим способом.
а) Аналитический вариант
Если известны хотя бы два значения скорости ( и ) при двух разных концентрациях
( и ), то порядок можно рассчитать по формуле:
ln − ln
=
ln − ln
В зависимости от исходных данных могут быть использованы как истинные, так и средние скорости реакции.
б) Графический вариант
При наличии достаточно большого числа экспериментальных данных порядок реакции может быть найден по графику через тангенс угла наклона прямой: = .
Если для нахождения порядка реакции методом Вант-Гоффа были использованы результаты одного опыта, и скорость реакции найдена в разные моменты времени по одной кинетической кривой, то определенный порядок называется временным , поскольку
= |
|||||
учитывает возможное изменение механизма, а следовательно и порядка, реакции под |
|||||
влиянием образующихся продуктов. |
|
|
|
|
|
Если же реакция была проведена несколько раз с различными начальными |
|||||
концентрациями, а скорость определена в момент времени |
или |
|
, то порядок реакции, |
||
найденный по таким данным, носит название истинного |
концентрационного |
|
, |
||
|
0 |
|
|
|
|
|
|
|
|
5 |
|

поскольку в начальный момент времени влияние продуктов на механизм процесса отсутствует.
Величины истинного и временного порядков для одной и той же реакции могут совпадать, могут и отличаться. В случае совпадения этих величин считают, что продукты реакции не влияют на скорость и механизм ее протекания. В случае, если временной и концентрационный порядки различаются, то имеет место ускорение или замедление процесса под влиянием продуктов реакции.
6


Лекция 10
СЛОЖНЫЕ РЕАКЦИИ
Сложная реакция состоит из нескольких элементарных стадий с участием одних и тех
же реагирующих веществ.
При изучении кинетики сложных реакций применяется принцип независимости
элементарных стадий:
−если в системе протекает несколько реакций, то каждая из них идет независимо от остальных, а скорость ее пропорциональна концентрациям реагирующих веществ согласно основному постулату химической кинетики;
−конечное изменение концентрации данного вещества является результатом всех независимо протекающих элементарных реакций, в которых оно принимает участие.
Рассмотрим три основных типа сложных реакций:
1)обратимые;
2)параллельные;
3)последовательные.
Обратимые реакции
Обратимая реакция первого порядка протекает по схеме:
идет одновременно в двух противоположных направлениях, каждая реакция имеет первый порядок и свою константу скорости. В некоторый момент времени в системе достигается состояние равновесия. Константа равновесия равна отношению констант скоростей прямой и обратной реакций с одной стороны, и отношению равновесных концентраций продукта реакции и исходного вещества – с другой:
,равн.
= =
,равн.
Система дифференциальных уравнений, описывающих изменение концентрации каждого участника реакции:
1

|
|
+ |
|
= − |
|||
|
= |
− |
|
|
|||
Для вывода кинетического уравнения обозначим:
, – начальные концентрации веществ А и В (если в начале реакции продукт В в системе
отсутствовал, то = 0;
– количество исходного вещества, прореагировавшее к данному моменту времени;
− количество исходного вещества, прореагировавшее к моменту равновесия.
Тогда скорость обратимой реакции определяется изменением концентрации исходного вещества:
= ( − ) − |
( + ) |
После преобразования и интегрирования получаем:
|
|
+ |
1 |
|
где |
= ln |
− |
||
|
|
|
− |
|
=
+
Всостоянии равновесия скорости прямой и обратной реакций становятся
равными: |
( − |
) = |
( + ) |
Отсюда: |
|||
|
− |
|
|
|
= |
+ |
= |
Таким образом, найти константы скоростей прямой и обратной реакции в отдельности можно, решая систему уравнений:
|
|
|
+ = − |
||
|
( + |
) |
|
= ( − |
) |
Кинетические кривые
Вид кинетических кривых зависит от соотношения констант скоростей прямой и обратной реакций, т.е. от величины константы равновесия:
2

1) |
> 1 |
|
|||
|
|||||
ну |
> |
К |
|||
ĸг |
|||||
|
|
|
|
||
2) < 1
4124
3)= 1
Игг kv
Кривые приведены для случая, когда в исходной смеси продукт В отсутствует.
Параллельные реакции
В ходе параллельных реакций одни и те же исходные вещества реагируют одновременно в двух и более направлениях с образованием различных продуктов. Схема параллельной реакции первого порядка, протекающей по двум направлениям:
3

Система дифференциальных уравнений, описывающих изменение концентрации
каждого участника реакции: |
|
|
|
|
|
= − |
− |
||
|
||||
|
|
|
|
=
⎪
=
Обозначим:
– начальная концентрация вещества А;
– количество исходного вещества А, прореагировавшее по обоим направлениям к данному моменту времени;
− количество исходного вещества А, прореагировавшее по первому направлению или количество образовавшегося продукта В.
− количество исходного вещества А, прореагировавшее по второму направлению или
количество образовавшегося продукта D.
Хг 412
Тогда скорость параллельной реакции:
= ( − ) + ( − )
После преобразования и интегрирования получаем:
1
+ = ln
−
Это уравнение позволяет рассчитать сумму констант скоростей обоих стадий. Для нахождения каждой из констант в отдельности необходимо иметь второе уравнение.
На протяжении всего хода реакции отношение концентраций продуктов остается постоянным и равным отношению констант скоростей соответствующих стадий:
=
Совместное решение двух последний уравнений позволяет найти константы скорости каждой из параллельных стадий.
Кинетические кривые
При протекании параллельной реакции первого порядка сумма концентраций всех участников процесса в каждый момент времени равна начальной концентрации вещества А:
+ + = ,
4
