lectiss Popovoy PH
.pdf
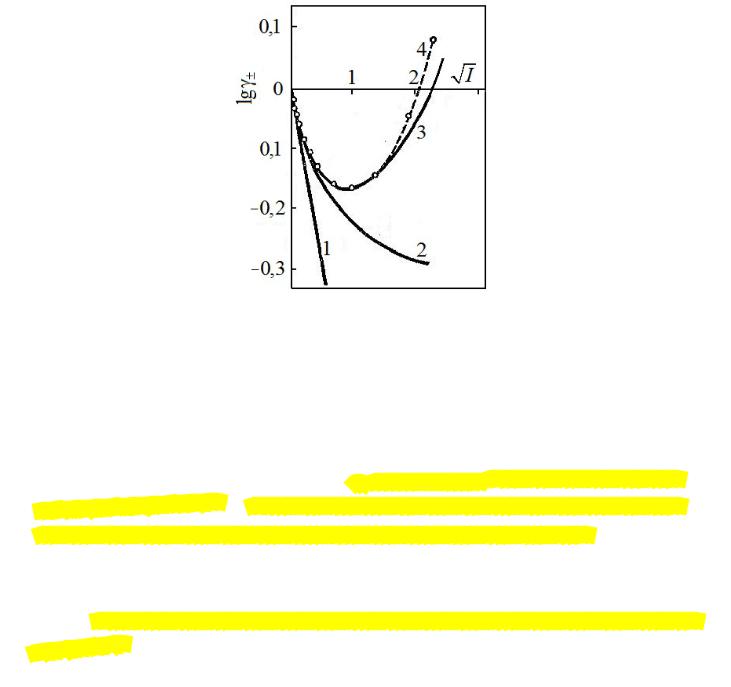
Рис. 2.3. Зависимость среднего ионного коэффициента активности от ионной силы в водном растворе
NaCl: 1 первое приближение теории Дебая Хюккеля; 2 второе приближение теории Дебая
Хюккеля; 3 третье приближение теории Дебая Хюккеля; 4 экспериментальные данные
Растворимость малорастворимых электролитов
При растворении малорастворимого электролита в том или ином растворителе,
например, в воде, очень быстро достигается состояние насыщенного раствора и дальнейшее растворение прекращается. При этом устанавливается состояние равновесия между твердым осадком малорастворимого соединения и его насыщенным раствором, т.е. состояние,
которое отвечает максимально возможной концентрации растворяемого вещества в данном растворителе при данной температуре.
Под растворимостью вещества имеют в виду концентрацию его насыщенного раствора. Важно отметить, что малорастворимый электролит в растворе находится в полностью диссоцированном состоянии, т.е. в растворе присутствуют только его ионы.
Произведение растворимости
Малорастворимый электролит в растворе ведет себя как сильный электролит и процесс его растворения можно представить с помощью следующей схемы:
KQ AQ |
o Q Kz Q Az |
|
|
осадок |
раствор |
По завершении процесса растворения устанавливается состояние фазового равновесия твердого вещества с его насыщенным раствором, которое характеризуется константой равновесия:
4

a ν + a ν
Ka = + a
Активность твердой фазы (в данном случае – осадка малорастворимого соединения)
по определению равна, a = 1. Тогда константа равновесия Ка выражается как произведение активностей соответствующих ионов. Эту величину называют произведением растворимости обозначают Ks ,ПР или L:
= |
∙ |
При определении растворимости электролита, плохо растворяющегося в воде, могут иметь место следующие три случая:
1)в растворе присутствует только малорастворимое соединение;
2)в насыщенном растворе малорастворимого электролита присутствует посторонний индифферентный – наблюдается незначительное увеличение растворимости;
3)в насыщенном растворе малорастворимого электролита присутствует посторонний неиндифферентный – наблюдается уменьшение растворимости.
Рассмотрим более подробно первый случай, когда в насыщенном растворе отсутствуют посторонние электролиты, то концентрации ионов будут равны: с Q с , а
с Q с , где с – концентрация насыщенного раствора, т.е. растворимость малораствори-
мого вещества. Обозначая растворимость буквой S, получаем:
= (Q сJ ) ν + (Q сJ ) ν QQ QQ SQJQr
С учетом того, что растворимость малорастворимого соединения чрезвычайно мала,
коэффициенты активности ионов, в отсутствии других электролитов можно принять равными единице, Ji 1 . В этом случае произведение растворимости определяется как произведение равновесных концентраций (молярных или моляльных) ионов:
=QQ QQ SQ
Отсюда легко рассчитать растворимость малорастворимого электролита:
S Q |
K s |
(моль/л). |
|
Q Q Q Q |
|||
|
|
5
Лекция 3
НЕРАВНОВЕСНЫЕ ЯВЛЕНИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Подвижность и скорость движения ионов
При наложении электрического поля возникает упорядоченное движение ионов к противоположно заряженным электродам (катоду и аноду). Катионы и анионы передвигаются к электродам с постоянной, но различной скоростью.
Скорость движения катиона υ+ (м/с):
= ∙
6 ∙ ,
Скорость движения аниона υ- (м/с):
= ∙ |
, |
6 ∙ ,
Скорость движения ионов при градиенте потенциала |
'U |
=1 В/м называют |
|
l |
|
подвижностью ионов (абсолютной скоростью движения ионов) и измеряется в (м2/(В·с)):
|
|
|
− катионов |
= 6 ∙ , |
|||
|
|
|
− катионов |
= 6 ∙ , |
|||
Применительно к растворам электролитов заданной концентрации величины: O+ = F· z+ и+ и O– = F z ·и– [См·м2/моль] 
называют молярными O электрическими проводимостями ионов.
Факторы влияющие на скорость и подвижность ионов |
мг . |
М |
|
||
x величина градиента; |
Гг |
|
xзаряд иона;
1

xприрода растворителя;
xрадиус иона;
xтемпература;
xконцентрация электролита.
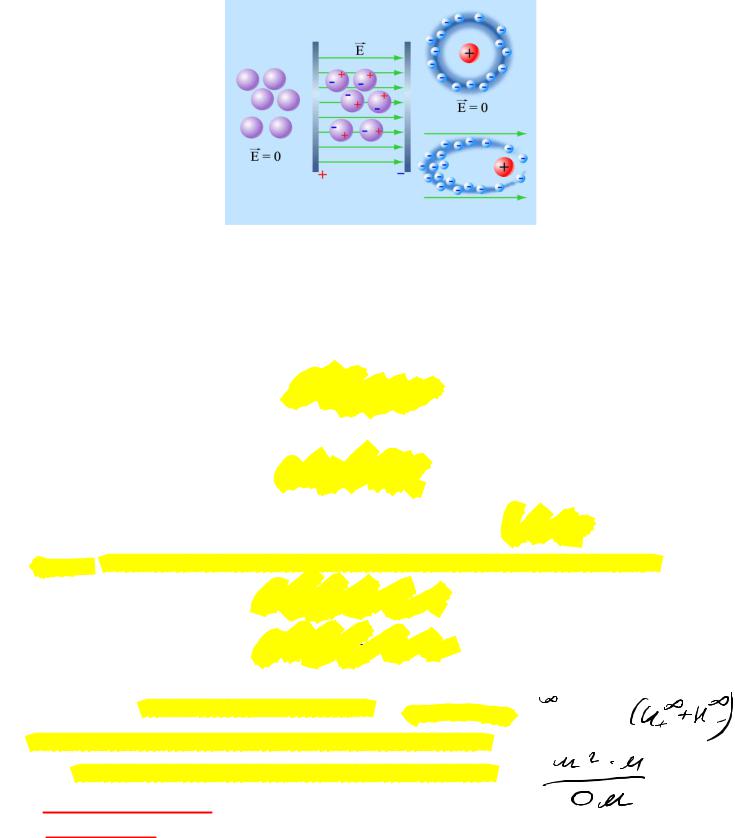
Аномальная электрическая проводимость ионов H+ и OH–
Электрические подвижности и молярные электрические проводимости ионов H и
OH аномально велики.
Для объяснения высоких значений электрических подвижностей и электрических проводимостей ионов H3O и OH Гротгусом был предложен так называемый
эстафетный механизм переноса электричества. Сущность предложенного Гротгусом механизма поясняет приведенная схема:
Электричество переносится, главным образом, не ионами гидроксония в ходе их перемещения к катоду, а протонами, передающимися от одной молекулы воды к другой как эстафетная палочка.
Аналогичным образом можно объяснить бόльшую подвижность гидроксид-ионов. В
этом случае протоны переходят от молекул воды к ионам OH , что приводит к видимому
перемещению ионов OH по направлению к положительному электроду:
2

Электрическая проводимость растворов электролитов
Электрическая проводимость (электропроводность) способность вещества проводить электрический ток под действием внешнего электрического поля. Электрическая проводимость растворов электролитов обусловлена наличием ионов, образующихся в результате электролитической диссоциации.
Для оценки электрической проводимости раствора используются две количественные характеристики: удельная электрическая проводимость и молярная электрическая проводимость.
Удельная электрическая проводимость
Величину, обратную удельному сопротивлению, называют удельной электрической
проводимостью (обозначается греческой буквой κ («каппа»): κ
l
RS
Единицы измерения удельной электрической проводимости См/м или Ом-1*см-1, где
-
См (сименс) = Ом-1.
-
Удельная электрическая проводимость раствора электролита это электрическая проводимость раствора электролита, заключённого между двумя плоско параллельными пластинами (электродами), площадью 1 м2 и расположенными на расстоянии 1 м друг от друга.
На удельную электрическую проводимость влияют следующие факторы: 1) природа электролита;
=2) природа растворителя; 3) концентрация (разведение) электролита; 4)=температура.
Молярная электрическая проводимость
Молярная электрическая проводимость может быть определена как электрическая проводимость объёма раствора электролита, содержащего 1 моль растворённого вещества и находящегося между двумя электродами, расположенными на расстоянии одного метра друг от друга.
Молярная электрическая проводимость выражается как отношение удельной электрической проводимости к молярной концентрации раствора:
κ
A) |
/ |
|
- |
|
с |
НЕ Ем . |
|||
|
3
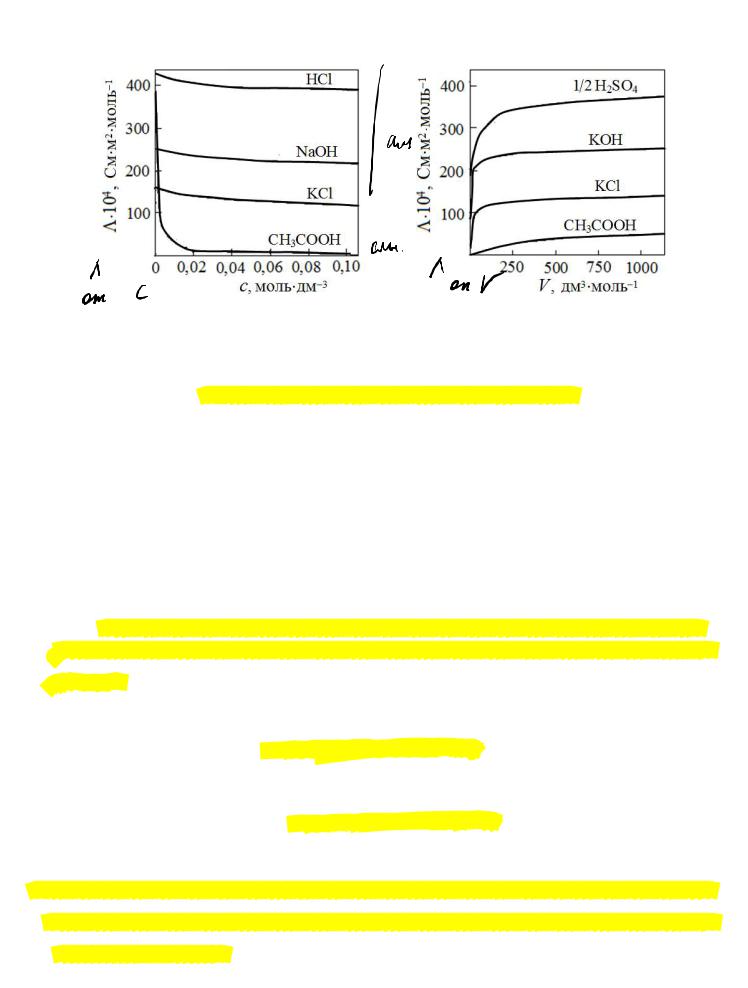
Для практических расчётов данное соотношение часто используют в несколько иной форме (зависит от единиц измерения величин в соотношении), а именно:
/ |
1000κ |
|
с |
До недавнего времени в электрохимии широко использовали понятие эквивалентной электрической проводимости (обозначение λ), соответствующее электрической проводимости слоя раствора, содержащего 1 моль-экв электролита и помещённого между двумя электродами, расположенными на расстоянии 1 м один от другого.
Связь молярной (Λ) и эквивалентной (λ) электрической проводимости даётся соотношением:
λfэ /
где |
fэ – фактор эквивалентности, определяемый как величина, обратная числу |
||||
эквивалентов вещества nэ ν z ν | z | |
νi zi : |
|
|||
|
fэ |
1 |
1 |
1 |
1 |
|
nэ |
νi zi |
ν z |
ν | z | |
|
|
|
||||
На молярную электрическую проводимость влияют следующие факторы:
1)природа электролита;
2)природа растворителя;
3)температура;
4)концентрация (разведение) электролита.
И
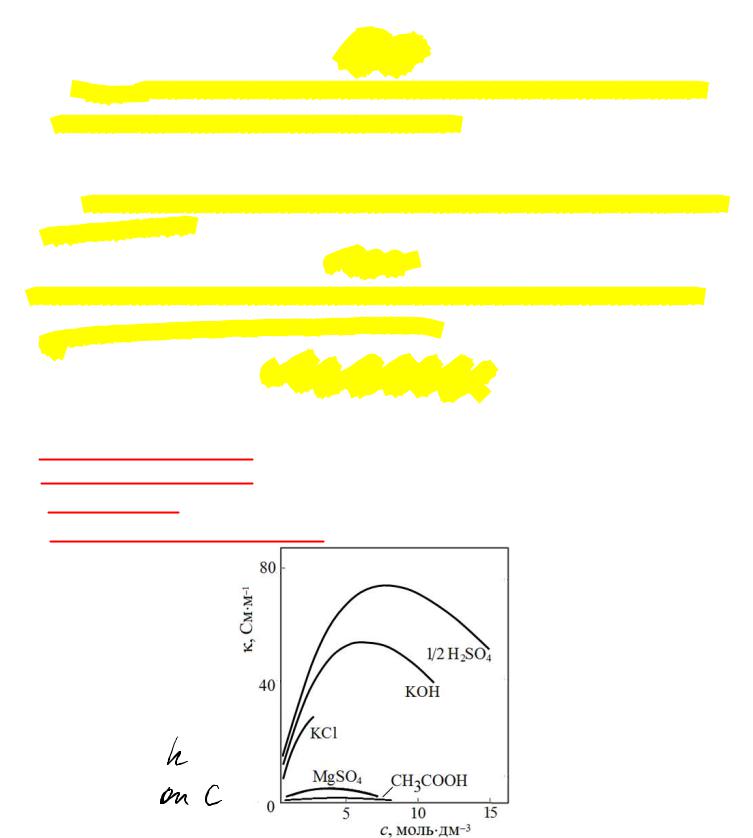
он С
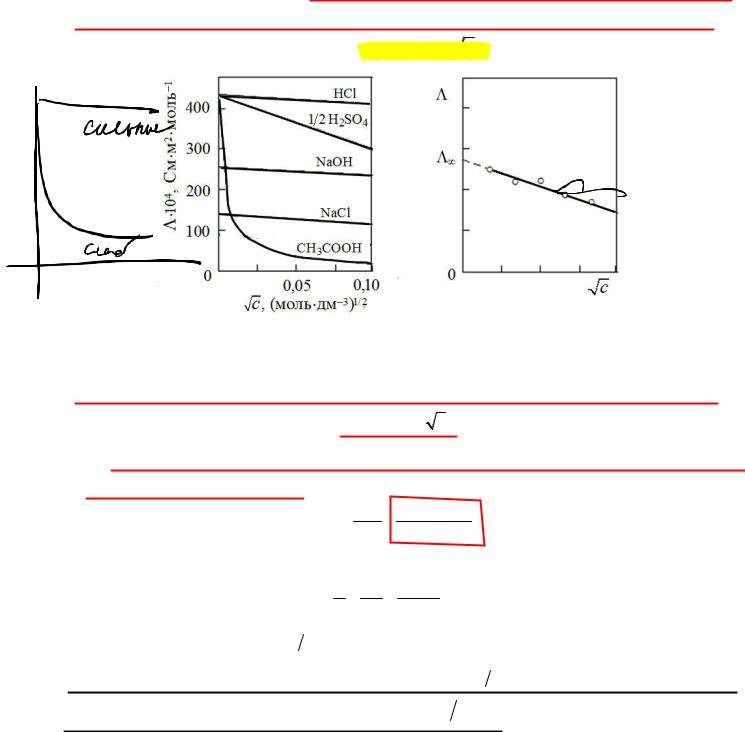
Рис. 3.1. Зависимость удельной электрической проводимости водных растворов электролитов
от концентрации
4

Введём понятие коэффициента электрической проводимости: |
снежно |
|||
/ |
D(ν O ν O ) |
D(u u ) |
- |
|
/f |
ν O ,f ν O ,f |
u ,f u ,f |
D f/ |
ди - уж |
f/ |
ν O ν O |
u u |
|
|
ν O ,f ν O ,f |
u ,f u ,f |
|
||
|
|
|||
Величина коэффициента f/ лежит в пределах 0 < f/ 1.
Для разбавленных растворов слабых электролитов имеем:
/ D /f
Для растворов сильных электролитов получаем:
/
/f f/
Кп # - 2
6