
lectiss Popovoy PH
.pdf
Кинетические кривые для случая, когда > :
Последовательные реакции
При протекании последовательной реакции продукт образуется из исходных веществ не непосредственно, а через образование одного или нескольких промежуточных веществ.
Самый простой случай – промежуточный продукт только один, и каждая стадия имеет первый порядок. Такая реакция протекает по схеме:
Продукт D образуется из исходного вещества А через образование промежуточного
вещества В.
Система дифференциальных уравнений, описывающих изменение концентрации
каждого участника реакции: |
|
|
|
= − |
|
|
||
|
= |
− |
|
||
|
= |
|
|
|
|
Изменение концентрации вещества А происходит как в обычной необратимой реакции первого порядка:
|
промежуточного |
|
|
, |
|
изменяется |
|
временем следующим |
|
Концентрация |
|
|
= |
|
В |
|
|
со |
|
образом: |
= , |
|
|
|
( |
− |
) |
|
|
|
|
|
|
|
|||||
В каждый момент времени сумма концентраций |
всех |
участников реакции равна |
|||||||
|
|
|
− |
|
|
|
|||
начальной концентрации вещества А:
5
+ + = ,
Отсюда получаем выражение для концентрации продукта D:
= , |
|
|
1 + − |
− − |
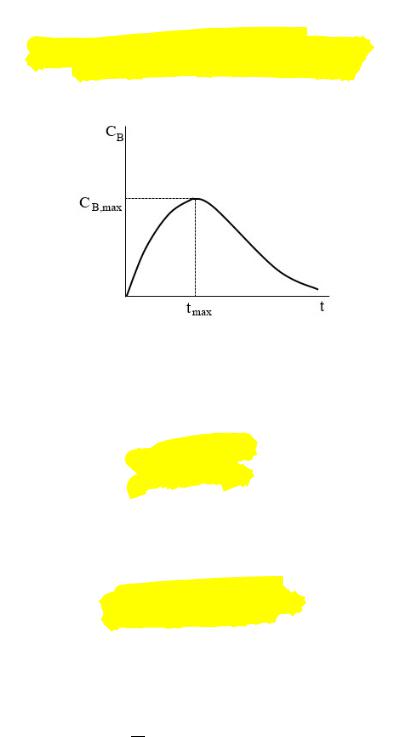
Зависимость = ( ) проходит через максимум.
Время достижения максимальной концентрации промежуточного продукта В ( |
|
) |
||
можно определить, приравняв нулю производную от соответствующего выражения. В |
итоге |
|||
|
|
|||
получаем: |
|
|
|
|
|
|
|
|
|
|
= |
ln |
|
|
− |
|
|
||
Если подставить выражение для в зависимость концентрации вещества В от времени, то после некоторых преобразований получим выражение для расчета максимальной концентрации промежуточного продукта:
, |
= , |
|
|
Таким образом, время достижения максимальной концентрации промежуточного вещества и сама эта концентрация определяются соотношением констант скорости первой и второй стадий.
С увеличением отношения максимум на кинетической кривой вещества В снижается и сдвигается влево.
6
Лекция 11
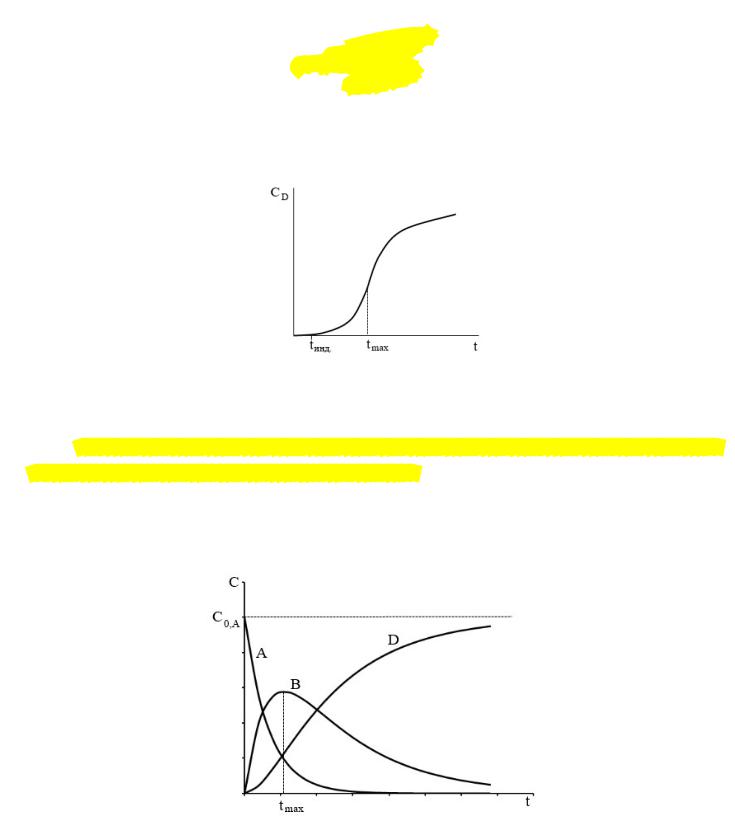
Зависимость концентрации продукта D от концентрации представляет собой S-
образную кривую. Координату точки перегиба на этой кривой находят, приравняв нулю вторую производную от функции = ( )
пер. = |
|
|
|
|
||
ln |
|
, |
|
|||
что совпадает с выражением для времени |
достижения |
|
. То есть максимальная скорость |
|||
|
|
− |
|
|
||
накопления продукта D соответствует |
максимальной концентрации промежуточного |
|||||
|
|
|
|
|
||
вещества В.
В начальный момент времени продукт реакции в системе практически не заметен, а
затем скорость его накопления начинает значительно увеличиваться.
Этот начальный период времени, когда продукт реакции в системе аналитически не обнаруживается, называется периодом индукции ( инд. на графике).
В общем случае кинетические кривые для всех участников рассматриваемой последовательной реакции можно схематически представить на одном графике следующим образом:
1
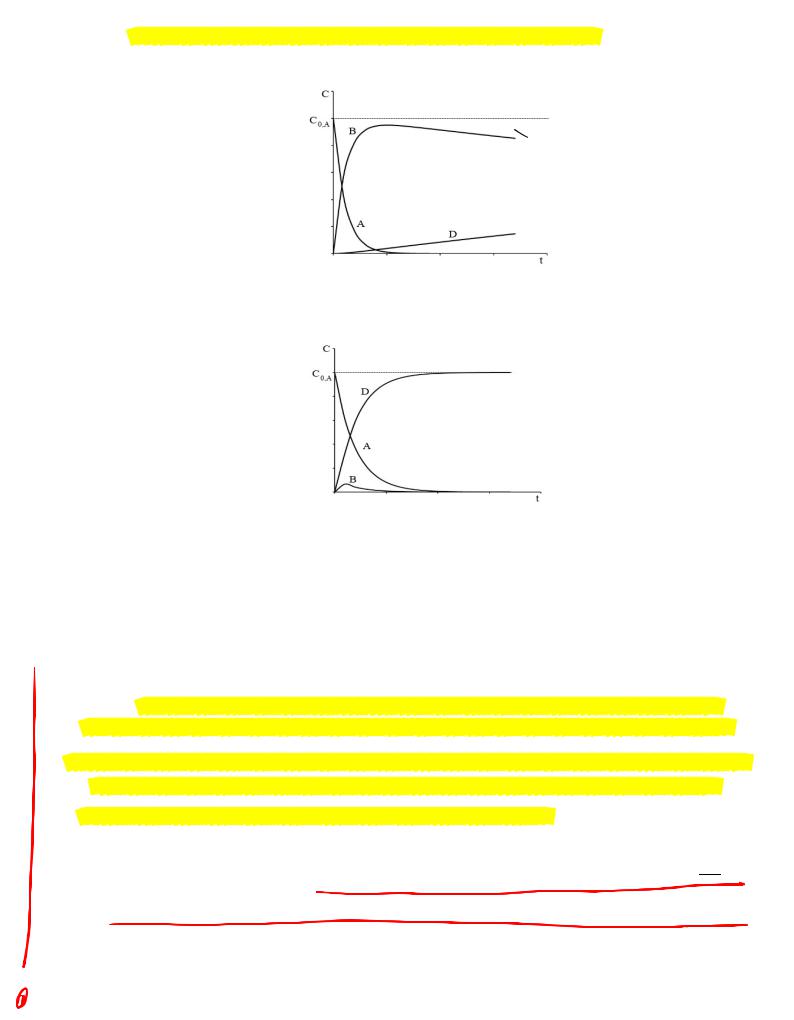

!кинетики сложных реакций, протекающих(через последовательные стадии с образованием промежуточных соединений или активных частиц.
ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
Скорость большинства реакций за очень редким исключением увеличивается при повышении температуры. Основное влияние температуры оказывает на константу скорости.
Поэтому, говоря о влиянии температуры на скорость, в первую очередь имеют ввиду изменение константы скорости с температурой.
Эмпирическое правило Вант-Гоффа
Зависимость скорости реакции от температуры можно охарактеризовать отношением констант скоростей, найденных для данной реакции при двух температурах, разница между которыми составляет 10 градусов, то есть величиной температурного коэффициента:
=
Согласно эмпирическому правилу Вант-Гоффа, при повышении температуры на каждые 10 градусов, скорость реакции возрастает в 2 – 4 раза. То есть величина температурного коэффициента Вант-Гоффа составляет от 2 до 4.
Это правило приближенное. эмпирическое, было установлено для реакций,
протекающих при сравнительно низких температурах. При повышении температуры величина температурного коэффициента уменьшается и стремится к единице при стремлении температуры к бесконечности: lim ( ) = 1.
Для констант при двух любых→ |
|
|
ни A- Тĸань) |
температурах: |
|
||
|
|
= |
|
Уравнение Аррениуса
Более точно зависимость константы скорости от температуры описывает уравнение
Аррениуса: |
|
|
|
= |
|
|
|
где – энергия активации реакции.
3
Аррениус предположил, что в реакцию могут вступать не все молекулы, а лишь обладающие повышенной энергией, достаточной для преодоления энергетического барьера реакции, то есть большей или равной энергии активации.
Энергия активации – некоторое избыточное количество энергии по сравнению со средней энергией молекул исходного вещества, которой должны обладать частицы, чтобы вступить во взаимодействие.
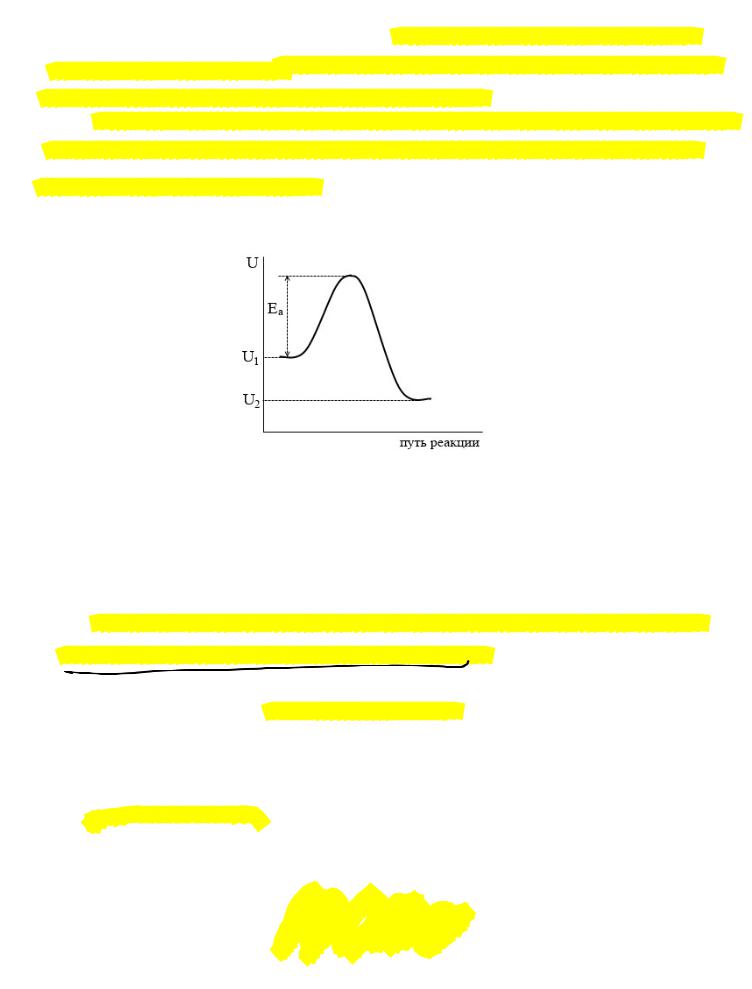
Изменение энергии системы в ходе экзотермической реакции схематически можно представить на графике:
где – средняя энергия исходных веществ, – средняя энергия продуктов реакции, (разность между ними равна тепловому эффекту реакции), – энергия активации прямой реакции.
Величина энергии активации определяется природой реакции, и в большинстве случаев считается не зависящей от температуры.
В случае сложной реакции опытная (эффективная) энергия активации является
некоторой функцией энергий активаций отдельных стадий.
-
Расчет энергии активации
Для определения энергии активации необходимо знать константы скорости реакции при разных температурах.
1) Аналитический метод Проводится интегрирование уравнения Аррениуса в некоторых пределах при условии ≠ ( ):
|
|
ln = |
|
|
|
где |
и |
|
и соответственно. |
||
– константы скорости реакции при температурах |
|||||
4

Лекция 12
ТЕОРИИ ХИМИЧЕСКОЙ КИНЕТИКИ
Основная задача теорий химической кинетики - предложить способ расчета константы скорости элементарной реакции и ее зависимости от температуры, используя различные представления о строении реагентов и пути реакции. Мы рассмотрим две простейшие теории кинетики - теорию активных столкновений и теорию активированного комплекса.
Теория активных соударений
Предпосылки теории:
xналичие в системе активных молекул, возникающих за счет неактивных столкновений по законам статистического распределения энергии;
xреакция может осуществляться только за счет столкновения активных молекул.
Согласно теории активных соударений, химическая реакция происходит при столкновении реагирующих частиц, обладающих энергией, равной или большей энергии
активации.
В простейшем варианте теории столкновений принимается, что для осуществления реакции атомы должны сблизиться на расстояние, равное сумме их газокинетических радиусов. При этом молекулы рассматриваются как жесткие сферы. Если не накладывать никаких ограничений на столкновения (т. е. считать, что реакция идет при каждом столкновении), то скорость реакции может быть отождествлена с числом двойных соударений в единице объема в единицу времени. Если предположить, что реакция не нарушает максвелл– больцмановского распределения по энергиям, то число двойных соударений можно вычислить
на основе кинетической теории газов.
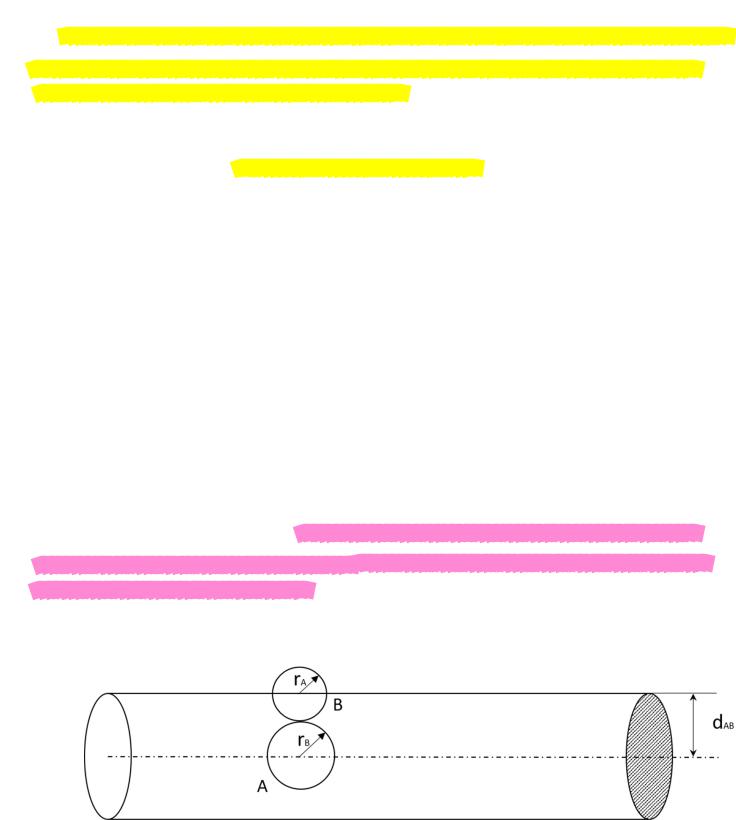
Соударение |
происходит, если центры молекул лежат внутри цилиндра с радиусом |
|
основания |
= |
+ . |
1

Для молекул А и В полное число соударений в единицу времени в единице объема
равно:
( |
+ ) |
|
= ( + ) |
8Б |
|
|
|
|
|
основания цилиндра); |
|||
– сечение соударений (площадь |
|
|||||
= |
Б |
– средняя относительная скорость движения молекул; |
||||
|
– приведенная масса; |
|
|
|
||
mA=и mB – массы молекул; |
|
|
|
|
||
nA и nB – концентрация молекул (число молекул в см3). |
||||||
|
|
|
|
|
|
|
|
|
|
Б |
|
||
|
|
|
= |
|
|
|
Для одинаковых молекул А число двойных соударений равно:
= |
1 |
(2 ) √2 |
8Б |
|
- тайно) |
2 |
|
|
|
|
|
|
Б |
– средняя относительная скорость движения одинаковых молекул; |
= √2 |
|
||||
– диаметр молекулы; |
|||||
= 2 |
|
|
|
||
m – масса молекулы;
1\2 – множитель, введенный в уравнение, чтобы каждое столкновение между молекулами не учитывалось дважды.
= Б
Учитывая, что в реакцию вступают только те частицы, которые обладают энергией равной или большей энергии активации, число активных соударений равно:
= ∙
= ∙
– доля активных соударений, суммарная энергия молекул которых равно или больше энергии активации.
Скорость бимолекулярной реакции равна числу активных соударений:
xдля реакции + → продукты
= − |
|
= |
|
= |
∙ |
|
= |
8Б |
|
|
∙ |
|
|
|
|||||||||
|
|
|
|
|
|
2

xдля реакции + → продукты
= − |
|
= |
|
= |
∙ |
|
= |
Б |
|
|
∙ |
|
|
|
|||||||||
|
|
|
|
|
|
Переходя от концентрации молекул/см3 к концентрации в моль/л и заменяя константу Больцмана Б на газовую постоянную R, а приведенную массу молекул на приведенную молярную массу , получаем уравнения:
= − |
|
= |
8Б |
|
|
|
∙ |
|
|
∙ |
|||||
|
|
|
|
|
1000 |
||||||||||
= − |
|
= |
|
Б |
|
|
∙ |
|
|
∙ |
|
|
|||
|
|
|
|
|
|
||||||||||
1000
Сравнивая полученные выражения с уравнением скорости бимолекулярной реакции
xдля реакции + → продукты
= − =
xдля реакции + → продукты
= − =
можно записать выражение для константы скорости реакции:
= |
8Б |
|
|
|
|
∙ |
|
|
∙ |
|
|
|
|
|
|
1000 |
|||||
= |
Б |
|
|
|
∙ |
|
|
∙ |
|
|
1000
Обозначим предэкспоненциальный множитель :
|
= |
8Б |
|
|
|
|
∙ |
|
|
|
|
|
|
|
1000 |
||||
|
= |
Б |
|
|
|
∙ |
|
|
|
1000
– фактор соударений, который показывает вероятность соударения друг с другом в
течение 1 секунды двух данных частиц, находящихся в единичном объеме.
= ∙
Полученное уравнение по форме напоминает уравнение Аррениуса:
= ∙
Энергия активации уравнения теории соударений отличается от опытной энергии активации уравнения Аррениуса.
3
