
lectiss Popovoy PH
.pdf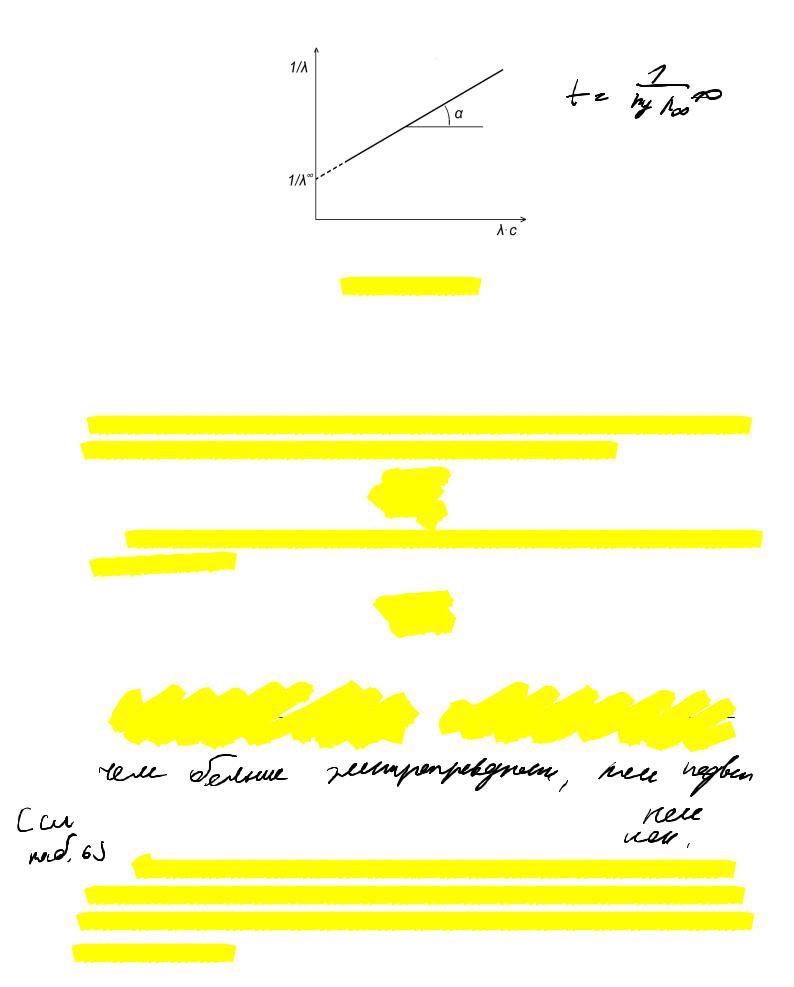
1-
1- г ну ĸто
Числа переноса
Каждый вид ионов переносит определённое количество электричества. Количество электричества, перенесённое данным видом ионов, зависит от заряда, концентрации ионов и от их электрической подвижности.
Для оценки вкладов катионов и анионов в перенос электричества введено понятие числа переноса иона - отношение количества электричества, перенесённого данным видом ионов, к общему количеству электричества, перенесённому всеми ионами:
|
|
|
t |
Qi . |
|
|
|
|
|
|
i |
Q |
|
|
|
|
|
|
|
|
|
||
Число переноса иона можно представить и как долю тока, перенесённого ионом |
|||||||
данного сорта: |
|
|
|
|
|
||
|
|
|
t |
Ii . |
|
|
|
|
|
|
i |
I |
|
|
|
|
|
|
|
|
|
||
В случае электролита K ν Aν , диссоциирующего на ν катионов и ν анионов: |
|||||||
t ,f |
u ,f |
|
ν O ,f |
t ,f |
u ,f |
ν O ,f |
|
u ,f u ,f |
ν |
O ,f ν O ,f |
u ,f u ,f |
ν O ,f ν O ,f |
|||
|
|
||||||
чем |
белым |
эееиггрепревдплги, |
тем педвеы |
||||
|
|
|
|
|
|
||
Влияние электростатического взаимодействия ионов на электрическую проводимость |
|||||||
( см |
|
|
растворов сильных электролитов |
неее |
|||
|
|
|
|||||
наб. |
65 |
ĸеĸ |
|
. |
|||
|
|
Согласно теории сильных электролитов Дебая-Хюккеля, каждый ион (в теории его
называют центральным ионом) окружен преимущественно ионами противоположного знака.
Это статистическое образование из ионов вокруг центрального иона получило наименование
ионной атмосферы. При наложении внешнего электрического поля центральный ион и ионная атмосфера, обладающие равными по величине, но обратными по знаку зарядами,
движутся в противоположных направлениях. В предельно разбавленном растворе ионы
2
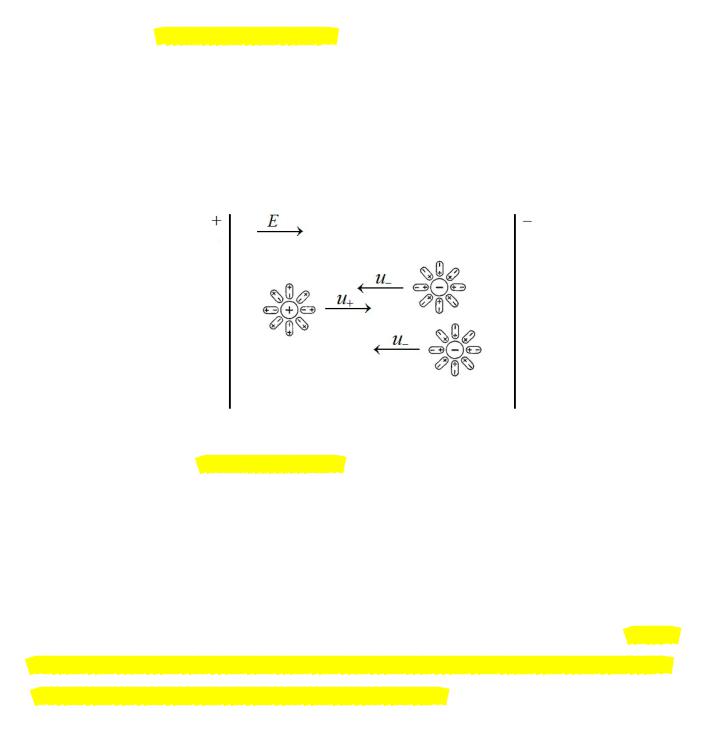
противоположного знака, окруженные сольватной (гидратной) оболочкой из молекул растворителя, при своем движении к соответствующему электроду (положительному или отрицательному) не препятствуют движению друг друга и перемещаются с максимально возможной скоростью (подвижностью). В достаточно концентрированных растворах,
напротив, гидратные оболочки ионов, движущихся в противоположных направлениях,
контактируют между собой и за счет сил трения скорость их движения, а значит, и
электрическая проводимость раствора, падает в сравнении аналогичной величиной для очень разбавленного раствора.
Электрофоретический эффект торможения( '/э )
Под действием электрического поля центральный ион начинает перемещаться к одному из электродов, а ионная атмосфера – в противоположном направлении, так как все ионы гидратированы, то при своём движении они одновременно переносят растворитель:
ион перемещается как бы во встречном потоке растворителя, это создаёт дополнительную силу трения, что приводит к снижению его подвижности и, как следствие, к снижению электрической проводимости.
Релаксационный эффект торможения ( '/р )
Поскольку ион и его ионная атмосфера при наложении внешнего электрического поля движутся в разных направлениях, то центральный ион смещается от центра ионной атмосферы, в результате чего нарушается ее симметрия относительно центрального иона. Во время движения иона новая ионная атмосфера не успевает сформироваться, а старая – полностью разрушиться. Позади движущегося иона возникает некоторый избыток зарядов противоположного знака, сферическая симметрия ионной атмосферы нарушается. Между ионом и остатками ионной атмосферы возникает противоположно направленное электрическое поле Ei , которое тормозит движение иона
3

Таким образом рассмотренные эффекты торможения вызывают уменьшение эквивалентной электрической проводимости раствора, что и учитывается коэффициентом A в уравнении
Кольрауша
/ /f ('/э '/р ) |
|
|
|||
Уравнение Онзагера: |
|
|
|
|
|
ª |
82, 4 10 5 |
|
8, 2 105 |
º |
c |
/ /f « |
(εT )1/2 η |
(εT )3/2 |
/f » |
||
¬ |
|
¼ |
|
||
Эффекты электропроводности электрических полей высокой напряжённости и высокой частоты
Эффект Вина: При высокой напряжённости электрического поля ионы движутся настолько быстро, что ионная атмосфера не успевает образовываться и её тормозящее действие исчезает, т.е. ни электрофоретический, ни релаксационный эффекты торможения не
проявляются ( '/э 0 , '/р 0 ), а |
электропроводность |
раствора электролита |
приближается к предельному значению ( / |
/f ). |
|
4
Эффект Дебая–Фалькенхагена: При наложении переменного электрического поля высокой частоты ион практически не имеет возможности сколько-нибудь значительно сместиться от своего исходного положения, совершая лишь небольшие колебания с очень малой амплитудой внутри ионной атмосферы, в результате ионная атмосфера не успевает в заметной степени разрушиться и сохраняет свою симметрию. ( '/р 0 ).
Измерение электропроводности как метод исследования
термодинамических свойств электролитов и ионных равновесий
Определение электрической проводимости называют кондуктометрическими измерениями или кондуктометрией. Кондуктометрия включает собственно методику измерения электрической проводимости и использование этого метода для определения термодинамических свойств растворов электролитов и для аналитических целей.
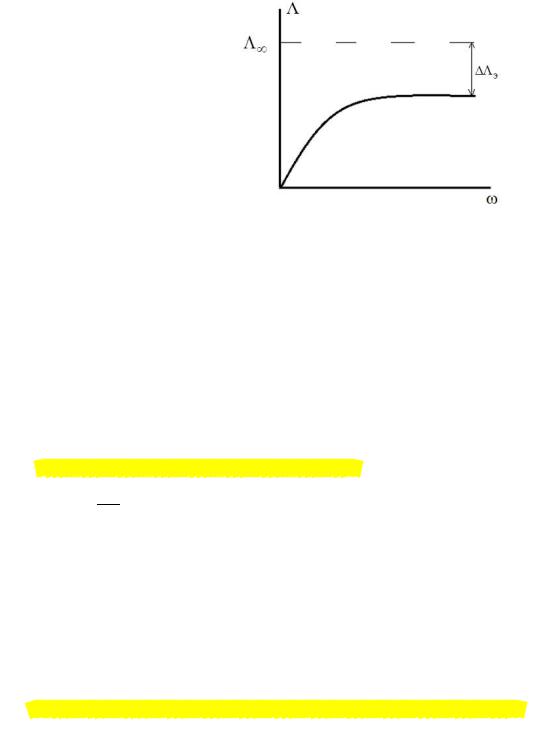
1. Определение степени диссоциации:
Λ
=
Λ
Λ вычисляют по измеренному значению κ: Λ = κ/с
Λ∞ определяют:
xпо справочным данным;
xпо методу Крауса– Брея;
xметодом комбинирования уравнений Кольрауша (вычисление Λ∞ слабого электроли-
та по данным о значениях Λ∞ сильных электролитов).
2.Определение константы диссоциации слабого электролита:
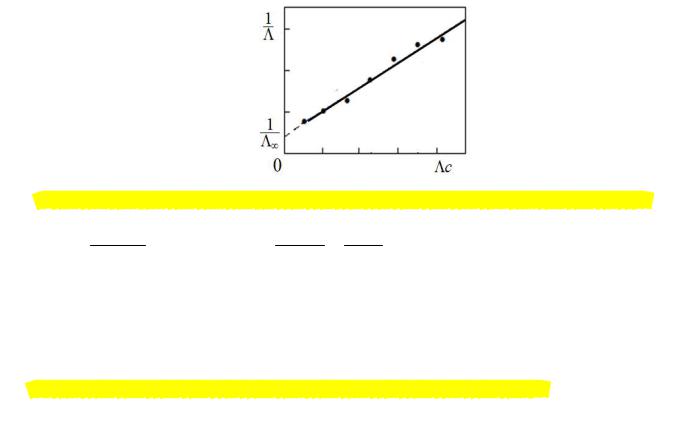
Зависимость 1 / f /c для слабого бинарного электролита выражается прямой линией
/ f /c для слабого бинарного электролита выражается прямой линией
с тангенсом угла наклона, равным 1 (KD /f2 ) .
(KD /f2 ) .
5
3. Определение термодинамических функций процесса диссоциации электролита:
а) |
d ln KDo |
'H Do |
, 'H o |
RT1T2 |
ln |
KDo ,2 |
|
dT |
RT 2 |
D |
T T |
|
K o |
|
|
|
|
2 1 |
|
D,1 |
б) 'Go |
RT ln K o |
|
|
|
||
|
D |
|
D |
|
|
|
|
o |
'H Do 'GDo |
|
|
|
|
в) 'SD |
T |
|
|
|
|
|
|
|
|
|
|
|
|
4. Определение растворимости малорастворимых соединений:
Насыщенный раствор малорастворимой соли является бесконечно разбавленным,
поэтому молярную электрическую проводимость раствора можно принять равной молярной электрической проводимости при бесконечном разбавлении (Λ ≈ Λ∞) .
s |
снасыщ |
κ |
, |
/f |
|||
где |
κ κнасыщ κH O |
||
|
|
|
2 |
6
Лекция 5
ОСНОВЫ ЭЛЕКТРОХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ
Электрод и гальванический элемент
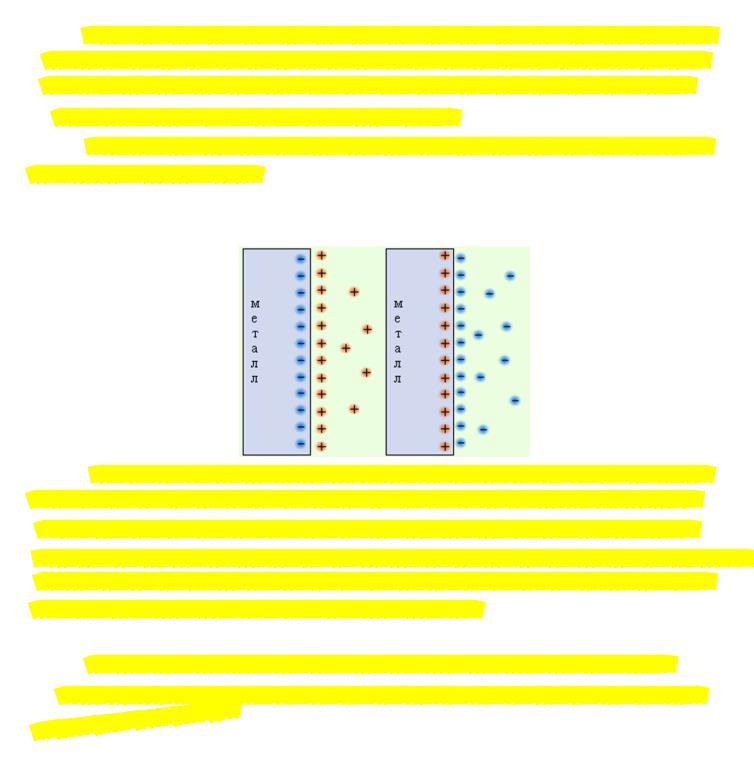
Электродом (полуэлементом) называется электрохимическая система, состоящая как минимум из двух контактирующих фазы, одна из которых является металлом
(проводником 1-го рода), полупроводником или ионной мембраной, а другая – раствором или расплавом электролита (проводником 2-го рода).
Электрод является донором или акцептором электронов, которые переходят из раствора или в раствор. По обе стороны границы раздела фаз возникают заряды противоположных знаков, происходит ориентация диполей растворителя и на границе металл-раствор двойной электрический слой.
Различают обратимые и необратимые электроды. Под обратимыми электродами
понимают электроды, на которых при изменении направления электрического поля (тока) на противоположное протекает та же самая по химической природе электродная полуреакция,
но в обратном направлении. В случае необратимого электрода изменение направления электрического тока сопровождается изменением и самой химической природы протекающего на нем электрохимического процесса.
Электрохимические цепи
Гальваническим элементом называют электрохимическую систему, которая вырабатывает электрическую энергию в результате самопроизвольно происходящих в ней химических превращений.
1

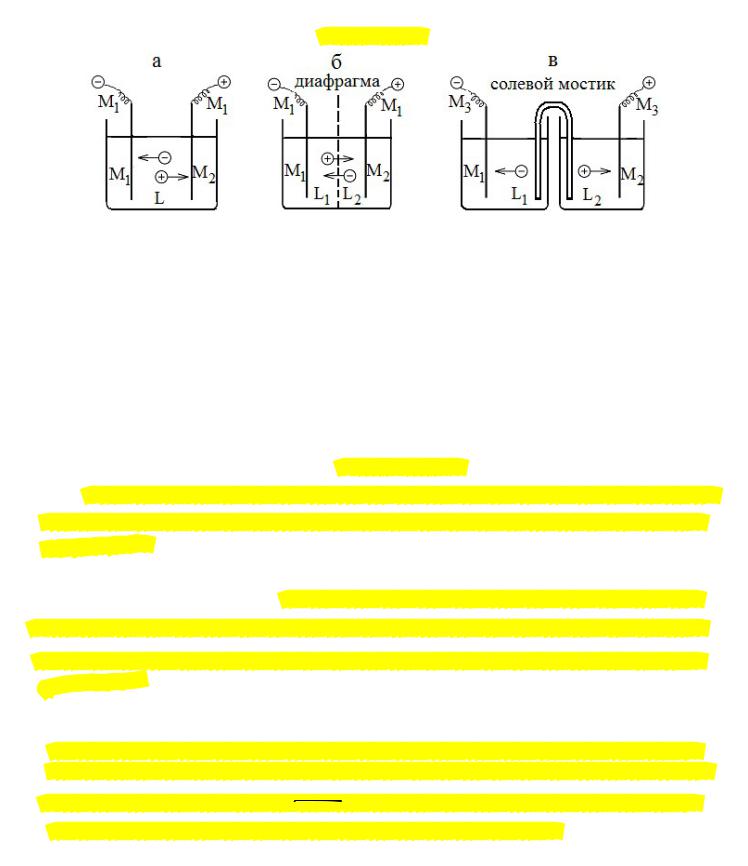
Рассмотрим электрохимические цепи, состоящие из двух электродов. На рисунке приведены
схемы электрохимических цепей: а – с одним раствором, б и в – с двумя растворами (с контактом
жидких фаз).
Типы цепей
Простейшая электрохимическая система состоит из двух электродов, имеющих один или два различных электролита. Для условной записи электрохимической системы
(гальванического элемента) применяется схема, в соответствии с которой слева указывается проводящий материал более отрицательного из электродов, затем раствор электролита, в
который помещается данный электрод, далее, раствор, в который погружен второй электрод,
и наконец, материал второго, более положительного электрода. В такой записи контакт двух растворов изображается пунктирной линией (на рисунке тип б).
М1| L1 L2 | M2
Приведенная условная запись гальванического элемента отвечает неправильно разомкнутой электрохимической цепи. Как видно, полюса такой цепи состоят из различных металлов.
При подключении гальванического элемента к нагрузке необходимо подвести к его полюсам токонесущие провода. Если, например, используются провода, выполненные из металла М2, то электрохимическая цепь - M2 | M1 | L1 L2 | M2 носит название правильно разомкнутой электрохимической цепи или правильно разомкнутого гальванического элемента.
На границе двух растворов, разделенных мембраной, существует скачок потенциала,
так называемый диффузионный (или жидкостной) потенциал, если растворы отличаются только природой или концентрацией электролита в одном и том же растворителе. Скачок
потенциалов при контакте двух жидких фаз, приготовленных с использованием различных
-
растворителей, то он называется фазовым жидкостным потенциалом. Электролиты могут контактировать через пористую перегородку (диафрагму) или помощи солевого мостика – U
– образной трубки, заполненной раствором электролита с близкими подвижностями ионов
2
(KCl, NH4NO3), иммобилизованном агар-агаром. Если диффузионный скачок потенциала каким-либо образом устранен или сведен к минимуму, например, посредством солевого мостика, то в схеме элемента это отражается двумя вертикальными линиями (на рисунке тип в). Например,
M2 | M1 | L1 || L2 | M2
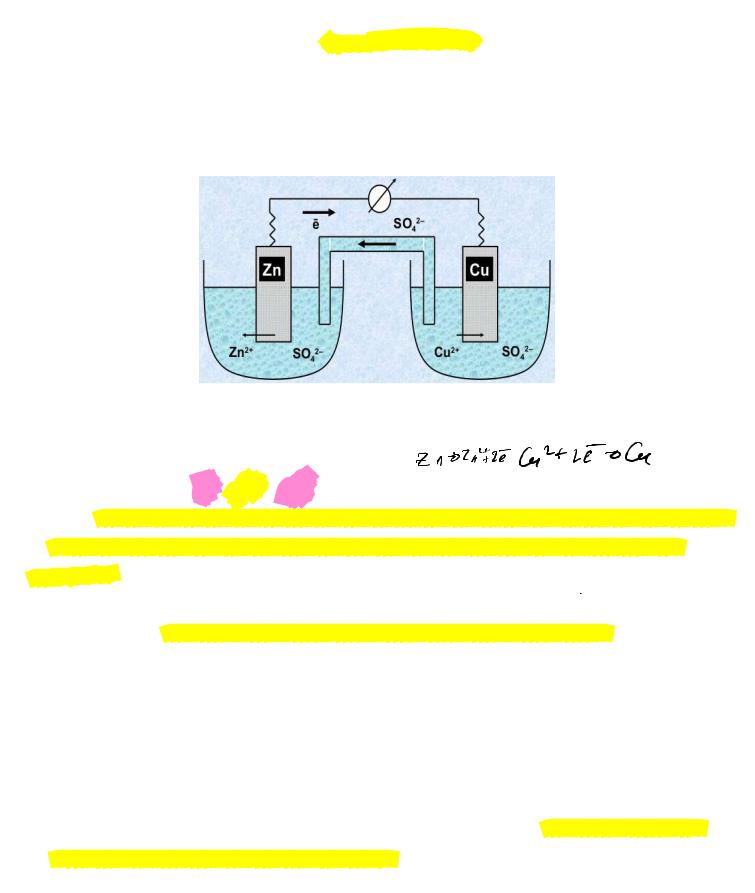
В качестве примера рассмотрим элемент Даниэля – Якоби, состоящий из медного и цинкового
электродов, погруженных в раствор сульфата меди и цинка соответственно.
Элемент Даниэля-Якоби
Суммарная реакция, протекающая в элементе: Zn0 + Cu2+ = Zn2+ + Cu0
Условная запись гальванического элемента: Zn Ый Сын По Сч
Cu | Zn | Zn2 || Cu2 | Cu или Cu | Zn | Zn2 ¦¦ Cu2 | Cu
Примечание: отрицательный электрод – реакция окисления и при записи элемента он располагается слева, положительный электрод – реакция восстановления, расположен справа.
ЭДС гальванического элемента. Электродный потенциал
ЭДС (E) отвечает разности потенциалов на концах равновесной электрохимической цепи, в которой на всех межфазных границах достигается состояние равновесия, а
диффузионный потенциал элиминирован. Она является той предельной величиной, к
которой стремится напряжение на клеммах элемента, когда I o 0 .
Поскольку экспериментально определить гальвани-потенциал (металл-раствор)
невозможно, для оценки величины потенциала электрода используют систему
относительных электродных потенциалов. В этой системе потенциал электрода
3
определяется по отношению к другому произвольно выбранному электроду (стандартному электроду), потенциал которого условно принимается равным нулю. В качестве такого
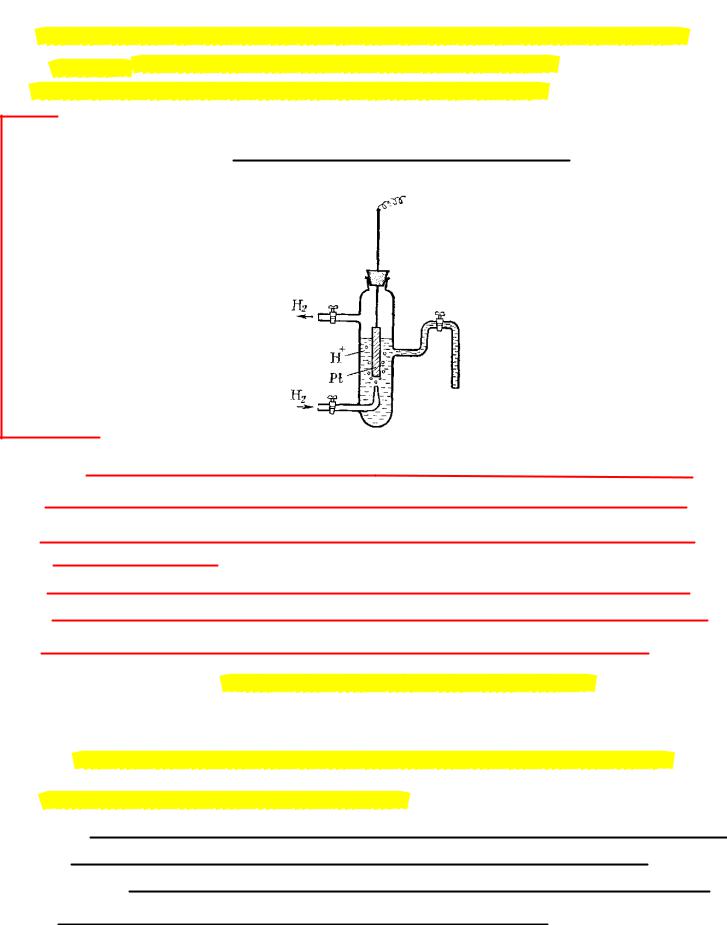
“нулевого” электрода был предложен стандартный водородный электрод.
Водородный электрод (рис. 1) представляет собой платиновую пластинку, частично погруженную в раствор, содержащий ионы водорода (раствор кислоты). Через раствор пропускается газообразный водород.
Стандартный водородный электрод – водородный электрод с активностью ионов водорода (гидроксония) в растворе aH 1 и давлением водорода pH2 1 атм .
Электродный потенциал стандартного водородного электрода принимается равным нулю
при всех температурах.
Под относительным электродным потенциалом или просто электродным потенциалом
понимают ЭДС электрохимической цепи, составленной из данного электрода (в схеме справа) и стандартного водородного электрода (в схеме слева), т.е. ЭДС элемента:
Pt | H |
2 |
( p |
1атм) | H |
(a |
1) || L | M | Pt |
|
H2 |
|
H |
|
В электрохимической цепи реакция разбивается на два электродных процесса или две окислительно-восстановительные полуреакции:
На электроде с более положительным стандартным электродным потенциалом протекает реакция восстановления (присоединение электронов): М1z+ + ze o М1,
На электроде с более отрицательным стандартным электродным потенциалом
протекает реакция окисления (отдача электронов): М2 o М2 z++ ze
4
