
lectiss Popovoy PH
.pdf
б) если k2 << k3 , тогда всё количество про-
межуточного вещества превращается в ко-
нечные продукты и скорость реакции про-
порциональна концентрации вещества (A),
из которого образуется вещество (АК);
промежуточное вещество в этом случае но-
сит название промежуточное вещество Вант Гоффа.
Выделяют кислотно-основный катализ (общий и специфический) и окислительновосстановительный.
(S – субстрат, Р – продукт)
Ферментативный катализ
Наиболее удивительными катализаторами являются ферменты (энзимы), катализиру-
ющие множество реакций в живых организмах. Ферменты представляю собой полипептиды с большим молекулярным весом и определённой пространственной структурой.
Простейшая схема ферментативного катализа включает обратимое образование про-
межуточного комплекса фермента (Е) с реагирующим веществом (субстратом, S) и превра-
щение этого комплекса в продукт реакции (Р):
Гетерогенный катализ
В каталитических реакциях, протекающих на поверхности твёрдого катализатора вы-
деляют пять основных стадий:
1)диффузия вещества к поверхности катализатора;
2)обратимая адсорбция вещества;
3)реакция на поверхности, в адсорбционном слое;
4)обратимая десорбция продуктов с поверхности;
3
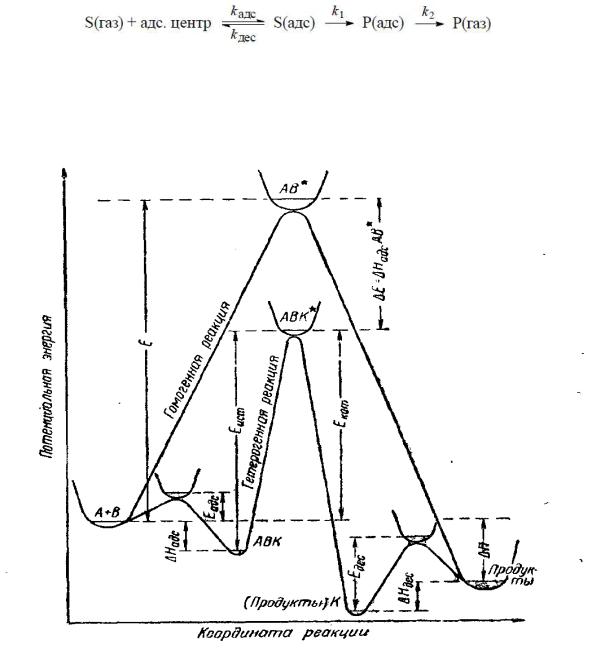
5) диффузия продуктов реакции от поверхности в объем.
Общая скорость определяется скоростью самой медленной из этих стадий. Простей-
ший механизм гетерогенного катализа описывается схемой:
На энергетическом профиле реакции, протекающей на поверхности катализатора,
проявляются дополнительные максимумы и минимумы, связанные с процессами адсорбции реагентов, десорбции продуктов и химической реакции в адсорбционном слое.
В зависимости от природы лимитирующей стадии гетерогенный процессы можно классифицировать следующим образом:
1)процессы, протекающие в диффузионной области (лимитирующая стадия – диффузия);
2)процессы, протекающие в кинетической области (лимитирующая стадия – химическая ре-
акция);
3) процессы, протекающие в переходной области (все стадии с соизмеримыми скоростями).
4

Одна и та же реакция может протекать в любой из названных областей. Если предста-
вить графически зависимость константы скорости от температуры во всех областях в коор-
динатах Аррениуса, то получим график, называемый кривой Зельдовича.
I – внутрикинетическая;
II – внутридиффузионная;
III – внешнекинетическая;
IV – внешнедиффузионная.
Конечно, на примере одного и того же процесса нельзя видеть весь спектр переходов от внешнедиффузионной до внешнекинетической области, практически невозможно прове-
сти одну реакцию в столь широком температурном интервале, но перемещения между со-
седними областями весьма вероятны.
5
