
Задачи Крюкова / Кинетика 6
.docx1. Образование этилового эфира муравьиной кислоты при 303 К протекает по уравнению обратимой реакции первого порядка
НСООН + С2Н5ОН![]() НСООС2Н5
+ Н2О.
НСООС2Н5
+ Н2О.
При изучении кинетики этой реакции были получены следующие результаты (концентрацию кислоты определяли титрованием):
t, мин |
0 |
1700 |
10000 |
14000 |
20000 |
40000 |
Объём кислоты, мл |
29.44 |
28.59 |
24.77 |
23.05 |
21.28 |
16.80 |
Константа скорости обратной реакции k-1 = 1.15·10-5 мин-1. Концентрация продукта прямой реакции в начальный момент равна 0. Определите константу скорости прямой реакции и константу равновесия.
2. Реакция С6Н5N(CH3)2 + CH3I → С6Н5N(CH3)3+ + I–
характеризуется
единичными частными порядками по каждому
из реагентов. При проведении реакции в
нитробензоле (растворитель) при 24.8 оС
константа скорости составляет 8.39·10-5
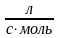 .
Рассчитайте время полупревращения
йодметана, если его начальная концентрация
составляла 0.01 моль/л, а начальная
концентрация диметилфениламина – 0.05
моль/л.
.
Рассчитайте время полупревращения
йодметана, если его начальная концентрация
составляла 0.01 моль/л, а начальная
концентрация диметилфениламина – 0.05
моль/л.
Решение:
Мы имеем дело с реакцией 2ого порядка. Запишем ее в виде:
А + В → Р
где А – С6Н5N(CH3)2 ,
В - CH3I ,
Р – (С6Н5N(CH3)3+ + I–)
Т.к. А ≠ В, то используем формулу:
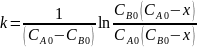
где
 – количество прореагировавшего вещества
А и В, либо получившегося вещества Р.
– количество прореагировавшего вещества
А и В, либо получившегося вещества Р.
Время полупревращения для реакции 2ого порядка:
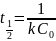
Если
в это уравнение подставить все значения,
то

В данном случае получить время полупревращение нельзя, т.к. когда прореагирует 20% С6Н5N(CH3)2 , то CH3I закончится полностью.
Если рассмотреть время полупревращения, за которое израсходуется половина CH3I (меньшего по количеству вещества), то получится, что:
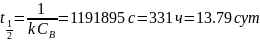
3. В растворе содержится 0.1 моль этилацетата и 0.1 моль NaOH. При 283 К в течение 15 минут омыляется 10% эфира, а при 298 К за тот же промежуток времени – 20%. Вычислите количество эфира, которое омыляется в течение 5 мин при 313 К.
Выразим уравнение в виде:
А + В → Р
Но т.к. концентрации веществ равны, можно переписать:
2А → Р
Для удобства составим таблицу:
T = 283K |
t = 15 мин |
10% эа |
T = 298K |
t = 15 мин |
20% эа |
T = 313K |
t = 5 мин |
Сэа - ? |
Найдем константы скорости для реакции 1ого порядка:
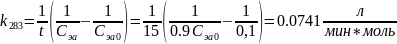

Определим энергию активацию Еа и через нее найдем k313 :


Из уравнения константы скорости выразим и найдем концентрацию Сэа:
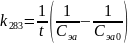

Ответ: 0.0852 или 8.52%
