
Задачи Крюкова / Кинетика 2
.docxЗадача 1.
Изучая кинетику некоторой реакции А → продукты, обнаружено, что при начальной концентрации реагента А, равной 4.86·10-3 моль/л, 50%-ная конверсия достигалась через 399 сек, при начальной концентрации, равной 2.28·10-3 моль/л, – через 696 сек. Определите порядок реакции и константу скорости реакции.
Решение:
Для определения порядка реакции используем метод Оствальда-Нойесса.
n=
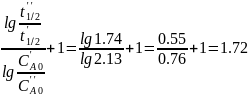
Реакция имеет дробный порядок. Для реакции n-ого порядка:
K=
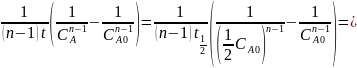
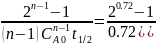 .
.
Ответ:
n= 1.72; K= 0.11
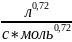 .
.
Задача 2.
Образование этилового эфира муравьиной кислоты при 303 К протекает по уравнению обратимой реакции первого порядка
НСООН + С2Н5ОННСООС2Н5 + Н2О.
При изучении кинетики этой реакции были получены следующие результаты (концентрацию кислоты определяли титрованием):
t,мин |
0 |
1700 |
10000 |
14000 |
20000 |
40000 |
V,мл |
29,44 |
28,59 |
24,77 |
23,05 |
21,28 |
16,80 |
Константа скорости обратной реакции k-1 = 1.15·10-5 мин-1. Концентрация продукта прямой реакции в начальный момент равна 0. Определите константу скорости прямой реакции и константу равновесия.
Решение:
Построим зависимость объёма кислоты от времени, где объём пропорционален концентрации.
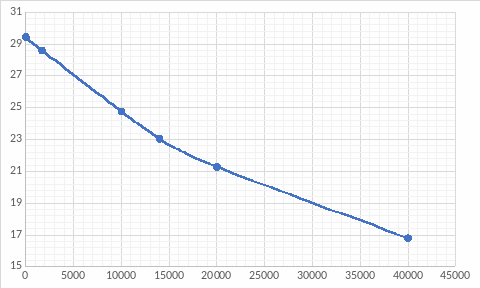
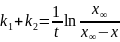
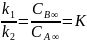
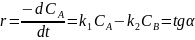
Построим касательную к точке t=0 мин:
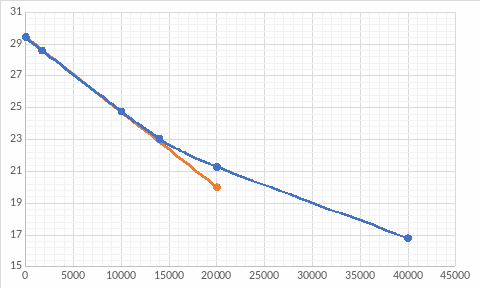
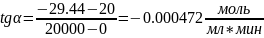
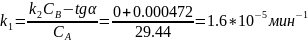
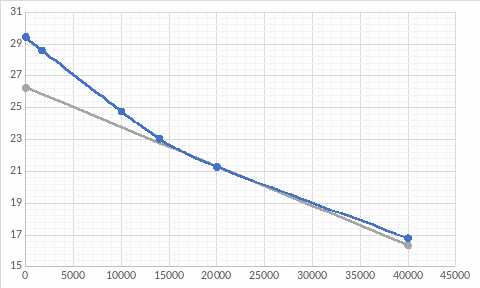
Для проверки ответа построим ещё одну касательную в точке t= 20000 мин:

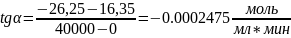
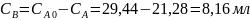
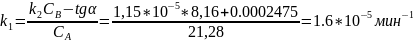
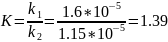
Ответ:
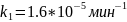 ;
К=1.39.
;
К=1.39.
Задача 3.
В растворе содержится 0.1 моль этилацетата и 0.1 моль NaOH. При 283 К в течение 15 минут омыляется 10% эфира, а при 298 К за тот же промежуток времени – 20%. Вычислите количество эфира, которое омыляется в течение 5 мин при 313 К.
Решение:
Омыление-
реакция второго порядка.
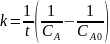
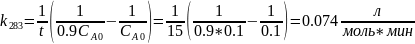
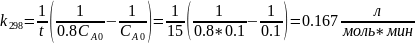
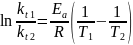
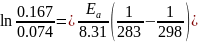
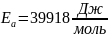
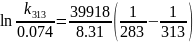
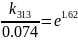
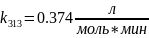
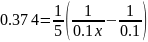
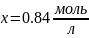
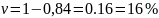
Ответ: 16%.
