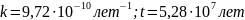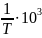Задачи Крюкова / Кинетика 17
.docx1). Экспериментальные результаты по определению константы скорости при разных температурах приведены в таблице:
T, K |
280 |
290 |
310 |
320 |
340 |
k·102, мин –1 |
0,497 |
4,450 |
201 |
3085 |
72780 |
|
3,571 |
3,448 |
3,226 |
3,125 |
2,941 |
ln k |
-5,304 |
-3,112 |
0,698 |
3,429 |
6,590 |
Найдите энергию активации, предэкспоненциальный множитель в уравнении Аррениуса и вычислите время полупревращения при 300 К.
Решение:
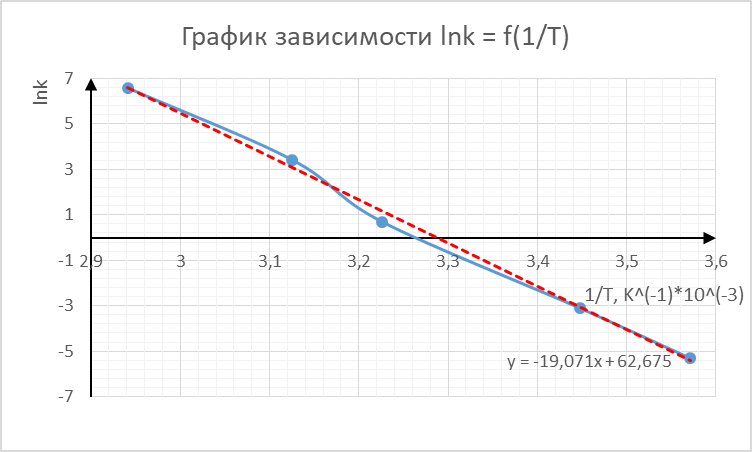
Данная задача на зависимость скорости
реакции от температуры. Из-за большого
количества данных стоит воспользоваться
графическим способом решения. Построим
график зависимости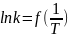 .
.
Зависимость константы скорости от температуры выражает уравнение Аррениуса:
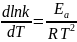
Затем интегрируя, и переводя в логарифмическую форму, получаем уравнение:
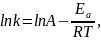
где
A
– предэкспоненциальный множитель,
 – энергия активации. Тангенс угла
наклона прямой, полученной на графике,
будет равен:
– энергия активации. Тангенс угла
наклона прямой, полученной на графике,
будет равен:
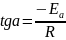
Исходя из графика, тангенс угла наклона прямой равен:

Энергия активации соответственно равна:
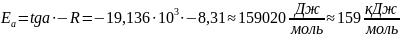
Предэкспоненциальный множитель А можно найти через уравнение Аррениуса, пользуясь табличными данными:
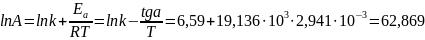
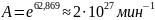
Стоит
отметить, что в задаче дана реакция
первого порядка (т.к.
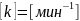 ).
Время полупревращения в реакциях первого
порядка вычисляется по формуле:
).
Время полупревращения в реакциях первого
порядка вычисляется по формуле:
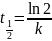
Находим константу скорости реакции при T = 300 K через уравнение Аррениуса:
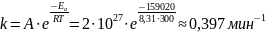
Через константу скорости, в итоге, вычисляем время полупревращения при T = 300 K:
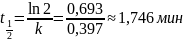
Ответ:
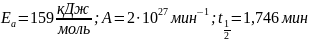
2). Синтез фосгена CO + Cl2 = COCl2 проводили при 300 К в одном и том же сосуде. В двух опытах получены следующие результаты: при начальных давлениях CO и Cl2 750 мм рт. ст. время половины реакции 62,4 мин, а при давлении 640 мм рт. ст. - 73,2 мин. Определите порядок реакции и константу скорости.
Решение: Данная задача на нахождение порядка реакции. Для её решения воспользуемся методом Оствальда-Нойесса. Так как данных немного, и особого смысла строить график по двум точкам нет, стоит использовать аналитический способ. Уравнение для расчёта порядка реакции по методу Оствальда-Нойесса по данным о времени полупревращения в двух опытах выглядит следующим образом:
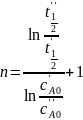
По данным из условия при начальных давлениях CO и Cl2 750 мм рт. ст. время половины реакции 62,4 мин, а при давлении 640 мм рт. ст. – 73,2 мин. Находим порядок реакции:

В задаче дана реакция второго порядка. Исходя из этого, формула для времени половины реакции будет выглядеть следующим образом:
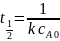
Через одно из известных начальных давлений и соответствующее ему время полупревращения можно рассчитать константу скорости реакции второго порядка:
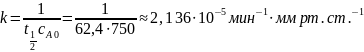
Ответ:

3). Для 235урана период полураспада равен 7,13·108 лет. Рассчитайте константу скорости этого процесса и определите, за сколько лет содержание 235урана в образце уменьшится на 5 %.
Решение: Стоит отметить, что с исключительной точностью подчиняются уравнению для реакций первого порядка все процессы радиоактивного распада. Поэтому и распад 235урана будет реакцией первого порядка. Отсюда можно написать уравнение для периода полураспада (или времени полупревращения) реакции первого порядка:
Отсюда можно быстро и легко сосчитать константу скорости реакции:
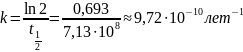
Если за какое-то время содержание 235урана в образце уменьшится на 5 %, то его концентрация будет равна соответственно:
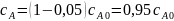
Уравнение для константы скорости реакции первого порядка:

Исходя из уравнения для константы скорости, можно рассчитать за какое время содержание 235урана в образце уменьшится на 5 %:
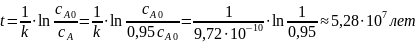
Ответ: