
Задачи Крюкова / Кинетика 8
.docx1. При взаимодействии эквивалентных количеств моноксида углерода и хлора по уравнению:
СО + Cl2 → COCl2
при 300 К в присутствии катализатора наблюдалось следующее уменьшение общего давления системы:
t, мин |
0 |
5 |
10 |
15 |
20 |
P·10-5, Па |
0,965 |
0,900 |
0,829 |
0,779 |
0,735 |
Определите порядок реакции (V = const).
Найти: n – ?
Решение:
В начальный момент времени в системе присутствуют только исходные вещества в стехиометрических количествах P0 (CO) и P0 (Cl2). В момент времени t некое количество х прореагировало. Составим таблицу:
Исходное t=0 |
P0 (CO) |
P0 (Cl2) |
0 |
t |
P0 (CO) - x |
P0 (Cl2) - x |
x |
P0 = 0,965 (P·10-5, Па) – значение в начальный момент времени.
P0 (CO) = P0 (Cl2) = 0,5 P0
Найдем P суммарное – общее давление в системе в момент времени:
P = P(CO) + P(Cl2) = 0,5 P0 – x + 0,5 P0 – x + x = P0 – x
Выразим из уравнения х: x = P0 – P
Находим давление P0 (CO) в каждый момент времени:
P0 (CO) = 0,5 P0 – x = 0,5 P0 – (P0 – P) = P – 0,5 P0
Строим зависимости lnP(CO) =f(t) ; 1/P(CO) = f(t) ; 1/P2(CO) = f(t).
t, мин |
P(CO), Па |
lnP(CO) |
1/P(CO) |
1/P2(CO) |
0 |
0,4825 |
-0,72877 |
2,07253886 |
4,295417 |
5 |
0,4175 |
-0,87347 |
2,395209581 |
5,737029 |
10 |
0,3465 |
-1,05987 |
2,886002886 |
8,329013 |
15 |
0,2965 |
-1,21571 |
3,372681282 |
11,37498 |
21 |
0,2525 |
-1,37634 |
3,96039604 |
15,68474 |
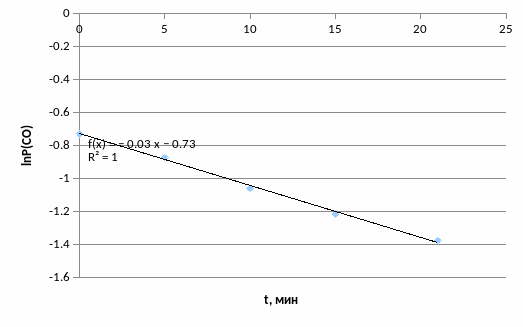
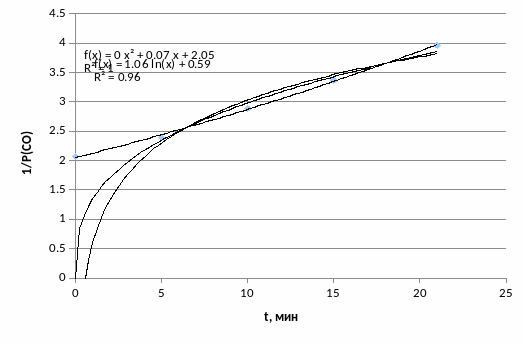
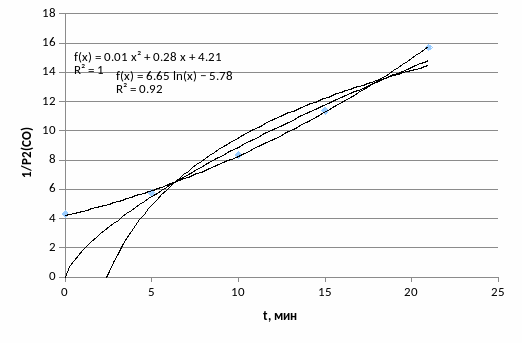
Так как lnP(CO)= f(t) – прямая линия, то n = 1. Логарифм (давления) концентрации для реакции первого порядка линейно зависит от времени.
Ответ: Первый порядок.
2. Реакция С6Н5N(CH3)2 + CH3I → С6Н5N(CH3)3+ + I–
характеризуется единичными частными порядками по каждому из реагентов. При проведении реакции в нитробензоле (растворитель) при 24,8 оС константа скорости составляет 8,39·10-5 л/с·моль. Рассчитайте время, через которое израсходуется 75% С6Н5N(CH3)2, если начальные концентрации реагентов были равны и составляли 0,1 моль/л.
Дано:
С6Н5N(CH3)2 + CH3I → С6Н5N(CH3)3+ + I–
С6Н5N(CH3)2 – А
CH3I – В
k = 8,39·10-5 л/с·моль
T = 24,8 оС
nA = 1; nB = 1 → n = 2 → Второй порядок.
XA = 75%
CA0 = CB0 = 0,1 моль/л
Найти: t – ?
Решение:
Воспользуемся кинетическим уравнением для реакций второго порядка.
Так как CA0 = CB0 = C0 , уравнение имеет вид:
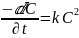
Проинтегрируем при граничных условиях времени от 0 до t . разделим переменные.
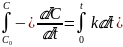
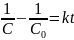
Найдем концентрацию реагентов в момент, когда израсходовано 75% С6Н5N(CH3)2
С = С0 (1 – ХА) = 0,1 (1 – 0,75) = 0,025 моль/л
Найдем время t через которое израсходуется 75% С6Н5N(CH3)2
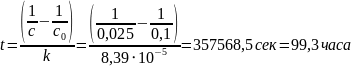
Ответ: через 99,3 часа.
3. Две реакции одинакового порядка имеют равные предэкспоненциальные множители, но их энергии активации различаются на 41.9 кДж/моль. Рассчитайте соотношение скоростей этих реакций при 600 К.
Дано:
Е2 – Е1 = 41,9 кДж/моль
n1 = n2 ; A1 = A2
Т = 600 К
Найти:
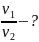
Решение:
При n1 = n2 отношение скоростей реакций будет прямо пропорционально отношению констант скоростей данных реакций.
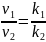
Зависимость константы скорости от температуры описывается уравнением Аррениуса:
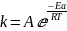
Найдем отношение констант скоростей реакций:
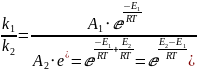
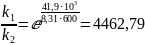
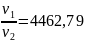
Ответ:

