
Задачи Крюкова / Растворы электролитов 1
.docx№1
Для
0,1 моляльного раствора
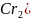 вычислить
среднюю ионную моляльность, среднюю
ионную активность, общую активность
электролита и ионную силу раствора при
298 К, если средний ионный коэффициент
активности этого раствора равен 0,0458.
вычислить
среднюю ионную моляльность, среднюю
ионную активность, общую активность
электролита и ионную силу раствора при
298 К, если средний ионный коэффициент
активности этого раствора равен 0,0458.
Дано:
m=
0,1
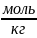 ;
;
T= 298 K ;
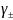 =
0,0458;
=
0,0458;
Найти:
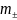 ;
;
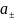 ;
;
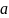 ;
I-
?
;
I-
?
Решение:
1)
Для нахождения средней ионной моляльности
применим следующую формулу: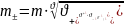
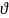 -количество
всех ионов электролита;
-количество
всех ионов электролита;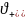 -количество
положительных ионов электролита (2
-количество
положительных ионов электролита (2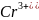 =
2 «+»);
=
2 «+»);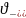 -количество
отрицательных ионов электролита (3
-количество
отрицательных ионов электролита (3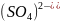 =
3 «-»);
=
3 «-»);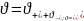 2
+ 3 = 5;
2
+ 3 = 5;
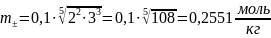 ;
;
2) Для нахождения средней ионной активности электролита используем формулу:
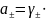 ;
;
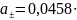 0,2551
= 0,0117
;
0,2551
= 0,0117
;
3) Для нахождения общей активности электролита возьмем формулу:
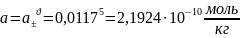 ;
;
4) Для нахождения ионной силы раствора электролита применим формулу:
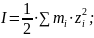 (
(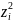 -
заряд иона электролита в квадрате)
-
заряд иона электролита в квадрате)
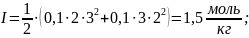
Ответ:
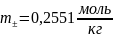 ;
;
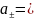 0,0117
;
0,0117
;
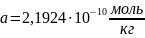 ;
;
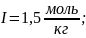
№2
Рассчитайте, сколько воды необходимо добавить к 1 л раствора гидроксида аммония с концентрацией 0,2 моль/л, чтобы количество продиссоциировавших молекул удвоилось. Степень диссоциации принять равной 0,01.
Дано:
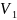 =
1 л.;
=
1 л.;
С=
0,2
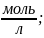

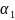 =
0,01;
=
0,01;
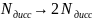 ;
;
Найти:
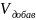 -
?
-
?
Решение:
1)
Эту задачу стоит решать через нахождение
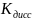 гидроксида аммония.
гидроксида аммония.
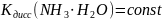 ;
;
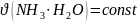 -
по условию добавляли только воду;
-
по условию добавляли только воду;
Так
как гидроксид аммония- слабый электролит,
то для него справедлив закон разбавления
Оствальда-
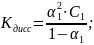
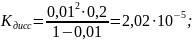
2)
Чтобы найти концентрацию раствора после
разбавления нужно узнать степень
диссоциации гидроксида аммония
полученного раствора. Нам известно по
условию, что после разбавления количество
продиссоциировавших молекул удвоилось.
Формула для расчёта степени диссоциации
выглядит так:
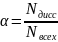 , где
, где
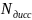 -
число продиссоциировавших молекул,
-
число продиссоциировавших молекул,
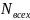 -
число всех молекул электролита. Последнее
остаётся постоянным, так как новых
молекул растворённого вещества не
поступало в систему, меняется только
числитель и, вследствие этого, результат.
Получается, при удвоении
-
удваивается
-
число всех молекул электролита. Последнее
остаётся постоянным, так как новых
молекул растворённого вещества не
поступало в систему, меняется только
числитель и, вследствие этого, результат.
Получается, при удвоении
-
удваивается
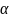 .
В итоге степень диссоциации гидроксида
аммония после разбавления равна 0,02.
.
В итоге степень диссоциации гидроксида
аммония после разбавления равна 0,02.
3) Подставляем полученную в формулу и выражаем новую концентрацию раствора:
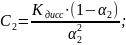
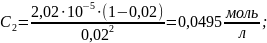
4) Через формулу молярной концентрации найдём новый объём раствора-
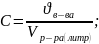
Учтём,
что
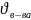 оставалось неизменным.
оставалось неизменным.
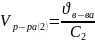 =
4,0404 литра;
=
4,0404 литра;
Следовательно,
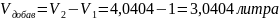 ;
;
Ответ:
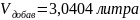 ;
;
№3
Твёрдая
фаза какого состава и в каком количестве
(в кг) выкристаллизуется при охлаждении
раствора фенол-анилин массой 15 кг,
содержащего 40 мол.% анилина, от 310 до 290
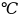 ?
Какой состав будет иметь раствор при
конечной температуре? Изобразите
схематично кривые охлаждения растворов
следующего состава: 92% анилина (эвтектика),
55% анилина, 100% фенола.
?
Какой состав будет иметь раствор при
конечной температуре? Изобразите
схематично кривые охлаждения растворов
следующего состава: 92% анилина (эвтектика),
55% анилина, 100% фенола.
Дано:
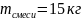 ;
;
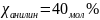 ;
;
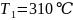 ;
;
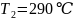 ;
;
Найти:
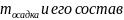 ;
состав раствора при 290
;
построить графики из условия;
;
состав раствора при 290
;
построить графики из условия;
Решение: (часть 1)
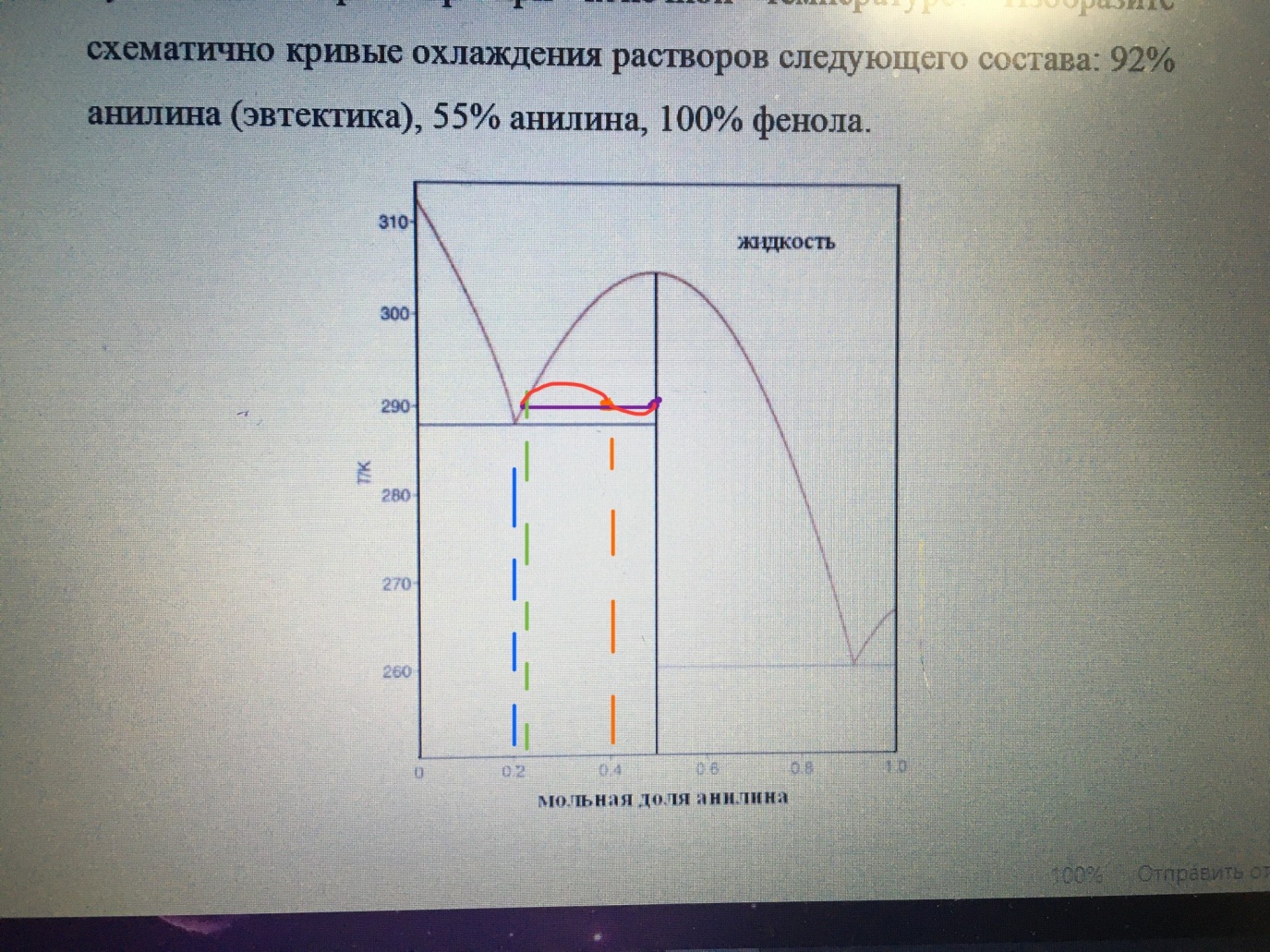
(рис. 1)
1) На рисунке 1 изображена диаграмма состояния 4-го рода системы «фенол- анилин». Область, где начерчена коннода (фиолетовая линия), является гетерогенной, так как она располагается между линиями ликвидуса (линия, выше которой все вещества в жидком состоянии)- бледно розовая кривая, и солидуса (линия, ниже которой все вещества в твёрдом состоянии)- тёмно- синий отрезок, чуть ниже конноды. В ней находятся жидкий раствор фенола и анилина, а также твердая фаза неизвестного состава.
Прежде всего на картинке отметим известную информацию- 40 мол.% анилина и 290 (рыжая точка). Из неё чертим конноду до линии ликвидуса влево, и вправо до чёрной вертикальной линии. Мы получили 2 отрезка. Тот, что примыкает к линии ликвидуса- будет отвечать за твёрдую фазу, а примыкающий к чёрной вертикальной линии- за жидкую фазу, находящейся в равновесии с твердой. Так как по графику не было возможно определить точное числовое соотношение отрезков, то внизу приведены примерные цифры:
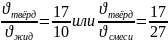 ;
;
(были использованы моли в соотношениях, так как в условии были даны мольные проценты)
Кристаллизоваться будет химическое соединение анилина и фенола, так как они оба находятся в гетерогенной зоне.
2) Найдём количество смеси (в молях) по формуле ниже:
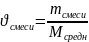 ;
;
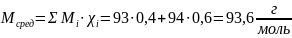 ;
;
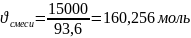 ;
;
3) Найдём количество выделившейся твёрдой фазы:
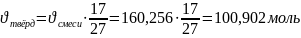 ;
;
4) Найдём массу полученных кристаллов:
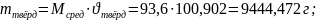
Ответ:
Масса выделившейся кристаллической фазы- 9,444 кг. Состав смеси: химическое соединение анилина и фенола. Состав оставшегося раствора при температуре 290 : фенол и анилин.
Решение: (часть 2)
Графики:
На рисунке 2 изображены исходная диаграмма и схематически 3 графика охлаждения: зелёный- эвтектика 92 % анилина, синий- 55% анилина и серый- 100% фенола.
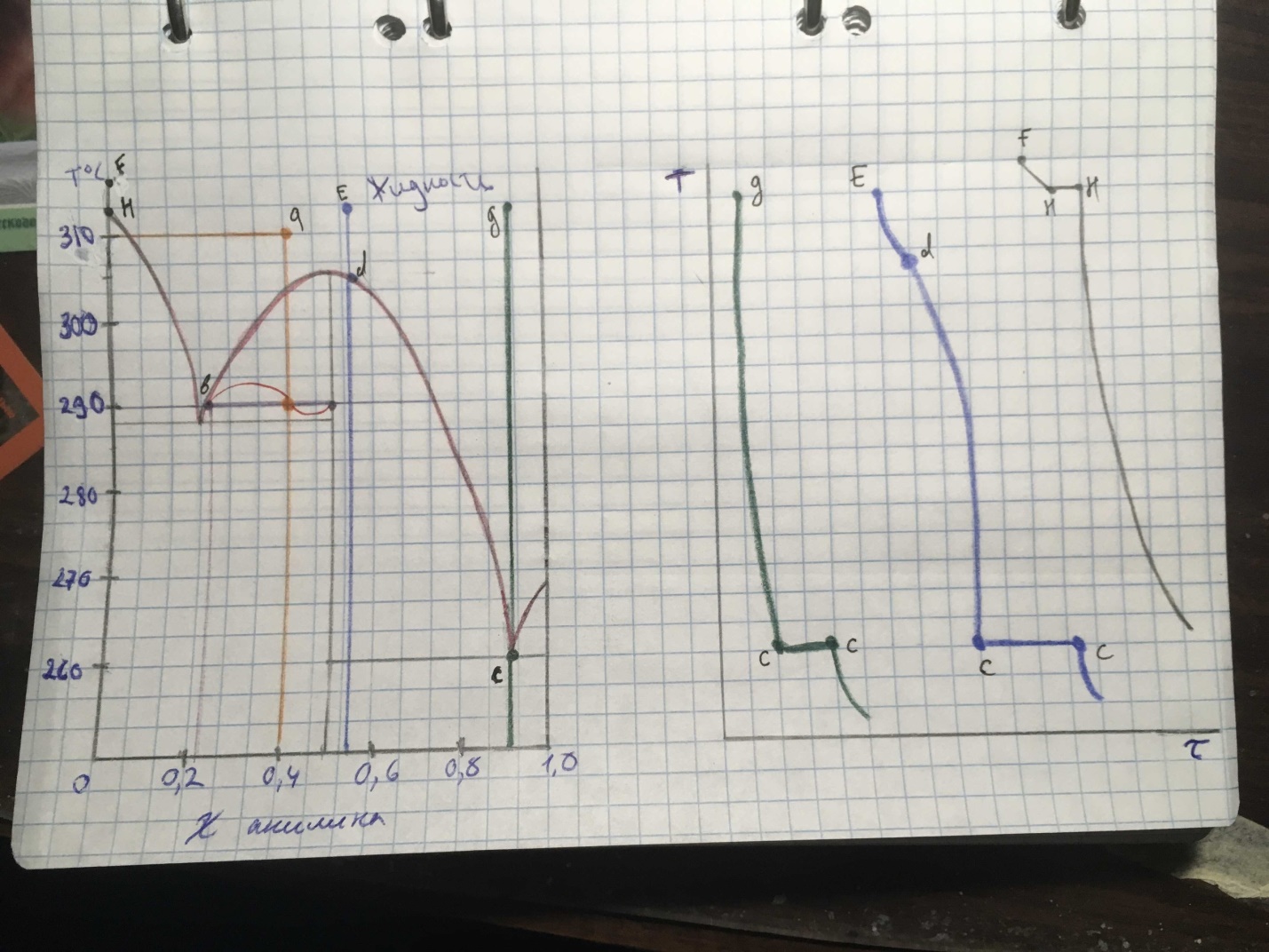
(рис.2)
