
Задачи Крюкова / Кинетика 9
.docxЗадача 1: При взаимодействии эквивалентных количеств моноксида углерода и хлора по уравнению:
СO (г.) + Cl2 (г.) = COCl2 (г.)
При 300 К в присутствии катализатора наблюдалось следующее уменьшение общего давления системы:
t, мин |
0 |
5 |
10 |
15 |
P*10-5, Па |
0.965 |
0.900 |
0.829 |
0.779 |
Определите порядок реакции (V=const)
Решение:
Поскольку в условиях задачи не указано время полупревращения (t1/2) и нет данных о скорости, следовательно, можно использовать метод подбора, суть которого заключатся в расчете констант по кинетическим уравнениям. Совпадение констант, рассчитанных по одному уравнению означает, что реакция имеет данный порядок.
I
порядок:

II
порядок:
 = kt
= kt
III
порядок:
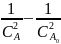 = 2kt
= 2kt
В математическом уравнении концентрацию исходных веществ в начальный времени и на данный момент времени можно заменить парциальным давлением, так как при Т=const концентрация пропорциональна давлению.
СO (г.) + Cl2 (г.) = COCl2 (г.)
-
Если T=0
P0/2
P0/2
0
Если T>0
P0/2-x
P0/2-x
x
PΣ = P0/2-x+ P0/2-x+x=P0 – x
x=P0 - PΣ
PСO = PCl2 = P0-x = P0/2-(P0 - PΣ) = PΣ-0.5P0
-
PCO * 10-5, Па
0.4825
0.4175
0.3465
0.2965
T, мин
0
5
10
15
Графический метод:
t, мин |
0 |
5 |
10 |
15 |
Pco*10-5, Па |
0,4825 |
0.4175 |
0.3465 |
0.2965 |
lnPco |
10.784 |
10.639 |
10.453 |
10.297 |
1/Pco |
2.073*10-5 |
2.395*10-5 |
2.886*10-5 |
3.373*10-5 |
1/P2co |
4.295*10-10 |
5.737*10-10 |
8.329*10-10 |
1.137*10-9 |
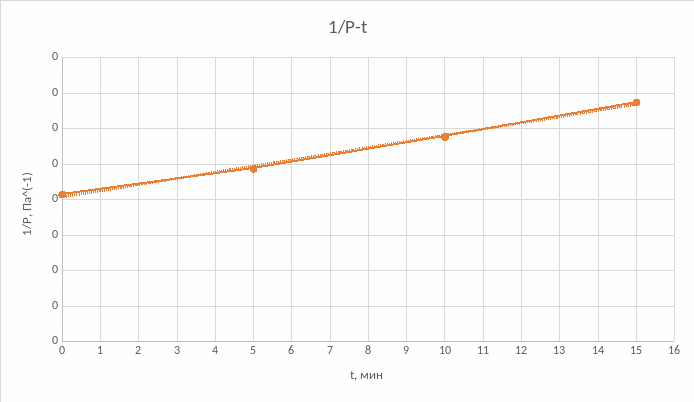
Графики:
Г рафик
№1
рафик
№1
График №2
Г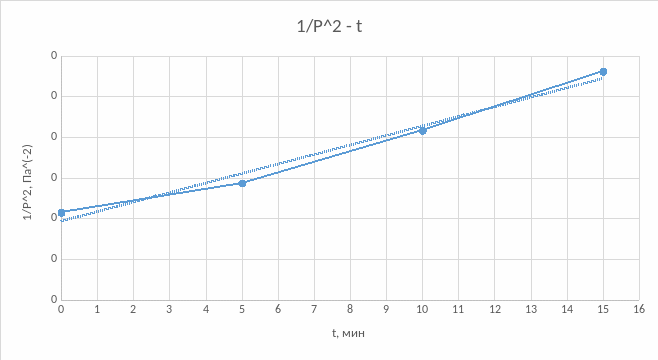 рафик
№3
рафик
№3
Ответ:
Исходя из построений можно сказать, что данная реакция относится ко второму порядку, так как линия тренда (линейная) наиболее близко располагается к графику №2
Задача 2: Соль диазония разлагается по уравнению
CH3C6H4N2Cl + H2O → CH3C6H4OH + N2 +HCl
Процесс разложения представляет собой реакцию первого порядка. Константы скорости реакции при 298 и 303 К соответственно равны 9·10-3 и 13·10-3 мин-1. Вычислите константу скорости при 308 К и время, в течение которого распадается 99% соли диазония при этой температуре.
Решение: Для определения значения константы при 308К необходимо найти энергию активации через уравнение Аррениуса, которое имеет следующий вид:
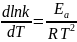
Если произвести определенной интегрирование, то получится следующее:


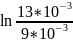 =
=
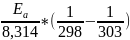 ,
Ea
=
,
Ea
=
 = 55210,5 Дж/моль
= 55210,5 Дж/моль
Для определения k при 308, аналогично используемся определенное интегрирование, меняя пределы:

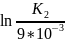 =
=
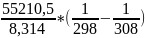 ,
,
K2
= 9*10-3
*

K2 = 0,0185 мин-1 = 18,5*10-3 мин-1
Из условия задачи реакция относится к первому порядку, следовательно, для определения времени используем кинетическое уравнение:
 ,
,
 ,
так как распадется 99%
соли диазония, следовательно от исходной
концентрации останется 1%
,
так как распадется 99%
соли диазония, следовательно от исходной
концентрации останется 1%
t=248, 93 мин ~ 4,15 ч
Ответ: константа скорости при 308К составляет 18,5*10-3 мин-1, за 4,15 ч распадется 99% соли диазония.
Задача 3: Реакция С6Н5N(CH3)2 + CH3I → С6Н5N(CH3)3+ + I–
характеризуется единичными частными порядками по каждому из реагентов. При проведении реакции в нитробензоле (растворитель) при 24.8 ˚С константа скорости составляет 8.39·10-5. Рассчитайте время полупревращения йодметана, если его начальная концентрация составляла 0.01 моль/л, а начальная концентрация диметилфениламина – 0.05 моль/л.
Решение: Поскольку порядок химической реакции может определяться, как сумма порядков реакции по веществам, в данном случае С6Н5N(CH3)2 и CH3I имеют единичные частные порядки из условия, то
n1=n2=1, то n= n1+n2=2
Общий
порядок реакции равен 2, можно сделать
вывод о том, что константа имеет
размерность

Поскольку
концентрации веществ С6Н5N(CH3)2
=
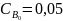

CH3I
=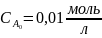
И
они различны ( ≠
≠ ),
следовательно
),
следовательно
 ,
поскольку необходимо найти время
полупревращения, то x=
,
поскольку необходимо найти время
полупревращения, то x= ,
поскольку это то, количество, которое
вступило в реакцию за данное время.
,
поскольку это то, количество, которое
вступило в реакцию за данное время.
Так,
 =
= =
= =
= =175145
с = 48,65 ч.
=175145
с = 48,65 ч.
Ответ:
 = 48,65 ч.
= 48,65 ч.
