
Задачи Крюкова / Кинетика 4
.docxЗа ходом химической реакции взаимодействия CaCO3 (т) с разбавленной соляной кислотой:
CaCO3 (т) + 2HCl(aq) = CaCl2 (aq) + CO2 (г) + H2O(ж)
следили по изменению объема выделенного газа CO2 за равные промежутки времени. Были получены следующие данные:
t, с |
0 |
15 |
30 |
45 |
50 |
100 |
∞ |
VCO2, см3 |
0 |
27 |
47 |
57 |
69 |
75 |
80 |
Рассчитайте константу скорости данной реакции, считая ее реакцией первого порядка по HCl и нулевого порядка по CaCO3 (т).
Решение
Реакция нулевого порядка по CaCO3 (т), по нему неудобно измерять уменьшение вещества за равные промежутки времени, поэтому решаем по HCl.
В реакции CaCO3 (т) + 2HCl(aq) = CaCl2 (aq) + CO2 (г) + H2O(ж)
в начальный момент времени концентрации:
соляной кислоты – C0(HCl) моль/л;
углекислого газа – 0 моль/л.
После начала реакции концентрации будут равны:
соляной кислоты – C0(HCl) - 2x (так как в реакции 2HCl) моль/л;
углекислого газа – x моль/л.
Реакция первого порядка по HCl, не нужно пересчитывать объем, так как для таких реакций объем пропорционален концентрации.
Рассчитаем константу скорости реакции:

Для данной реакции:
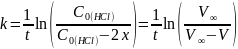 ,
где
,
где
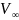 - максимальный объем CO2
при времени t = ∞,
который будет пропорционален начальной
концентрации HCl.
- максимальный объем CO2
при времени t = ∞,
который будет пропорционален начальной
концентрации HCl.
Вычислим константы:

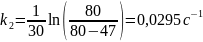


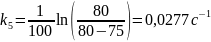
Среднее значение константы скорости реакции равно 0,0304 с-1
Ответ: k = 0,0304 с-1
Вещество А смешано с В и С в равных концентрациях (С0 = 0,2 моль/дм3). Через 20 мин осталось 50 % вещества А. Сколько вещества А останется через 40 мин, если реакция имеет нулевой, первый, второй, третий порядок?
Решение
вещество |
A |
B |
C |
моль/л |
0,2 |
0,2 |
0,2 |
Для реакции нулевого порядка константа скорости равна:
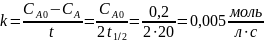
Тогда
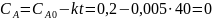
Для реакции первого порядка константа скорости равна:
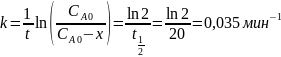
Тогда
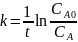 ;
;
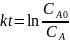 ;
;
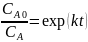
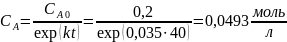
Для реакции второго порядка константа скорости равна:

Тогда
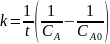 ;
;
 ;
;
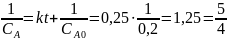

Для реакции третьего порядка константа скорости равна:
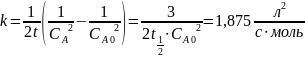
Тогда
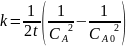
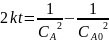
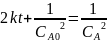
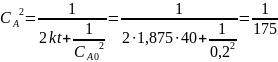
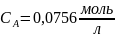
Ответ: если реакция имеет нулевой порядок, то через 40 минут вещества А не останется; если реакция имеет первый порядок, то через 40 минут останется 0,0493 моль/л вещества А; если реакция имеет второй порядок, то через 40 минут останется 0,8 моль/л вещества А; если реакция имеет третий порядок, то через 40 минут останется 0,0756 моль/л вещества А.
Монохлоруксусная кислота при 298 К взаимодействует с водой (вода взята в большом избытке):
СH2ClCOOH + H2O = CH2(OH)COOH + HCl
Кинетика этой реакции изучалась путем титрования проб одинакового объема раствором щелочи. Результаты титрования приведены ниже:
Время, мин |
0 |
600 |
780 |
2070 |
Количество щелочи, мл |
12,9 |
15,8 |
16,4 |
20,5 |
Вычислить константу скорости и рассчитать, сколько времени после начала реакции необходимо, чтобы все три кислоты присутствовали в эквивалентных количествах.
Решение
В начальный момент времени титруется только монохлоруксусная кислота, но с течением реакции образуются соляная и гликолевая кислоты, которые также титруются. Вода взята в большом избытке, поэтому мы не можем определить общий порядок реакции, а только по монохлоруксусной кислоте. Попробуем подобрать порядок реакции методом подстановки.
Константа скорости для реакции первого порядка равна
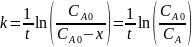
Реакция первого порядка, не нужно пересчитывать объем, так как для таких реакций объем пропорционален концентрации.
В начальный момент времени концентрации:
монохлоруксусной
кислоты –
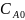
гликолевой кислоты – 0 моль/л
соляной кислоты – 0 моль/л
После начала реакции концентрации будут равны:
монохлоруксусной
кислоты –
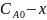
гликолевой
кислоты –
 моль/л
моль/л
соляной кислоты – моль/л
Щелочь титрует все три кислоты, значит считаем концентрацию
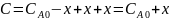
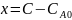
В формулу подставим объемы пропорциональные каждой концентрации и получим:
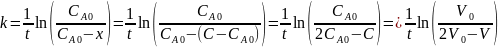
Константы скорости первого порядка:
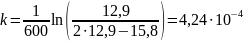
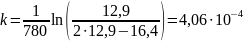
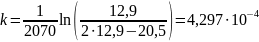
Константы примерно равны, данная реакция – реакция первого порядка, среднее значение равно 4,199 ∙ 10-4 мин-1,
Монохлоруксусная, гликолевая и соляная кислоты будут в эквивалентных количествах, когда останется 50% монохлоруксусной кислоты, то есть нужно найти время ее полураспада по формуле:

Ответ: k = 4,199 ∙ 10-4 мин-1, t1/2 = 1650,7 мин или 27,5 часов.
