- •2. Лекарственные вещества, содержащие фенольный гидроксил
- •2.4. Реакция окисления
- •3. Лекарственные вещества, содержащие карбонильную группу (альдегидную, кетонную)
- •3.1. Реакция окисления
- •5. Лекарственные вещества, содержащие первичную ароматическую аминогруппуАминами называются производные аммиака, в которых один, два или три атома водорода заменены на углеводородные радикалы.
- •6. Лекарственные вещества, содержащие ароматическую нитрогруппу
- •7. Лекарственные вещества, содержащие вторичную аминогруппу
- •8. Лекарственные вещества, содержащие сложноэфирную группу
- •9. Лекарственные вещества, содержащие амидную группу (продолжение)
- •10. Лекарственные вещества, содержащие сульфамидную группу
- •11. Лекарственные вещества, содержащие ковалентно связанный галоген
- •12. Лекарственные вещества, содержащие азометиновую группу, ковалентно связанную серу, пиридиновый цикл, ароматический радикал, непредельную связь
- •Химические свойства
- •Реакции подлинности
 1.
Лекарственные вещества содержащие
спиртовой гидроксил.
1.
Лекарственные вещества содержащие
спиртовой гидроксил.
СH3CH2OH – этиловый спирт
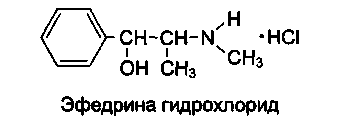
CH2OH|
CHOH глицерин
|
CH2OH
Спиртовой гидроксил Alk-OH – это гидроксил, связанный с алифатическим или алициклическим углеводородным радикалом.
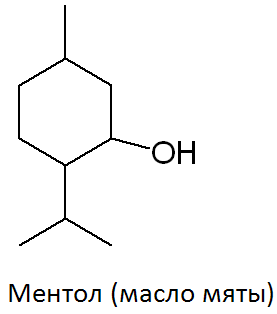
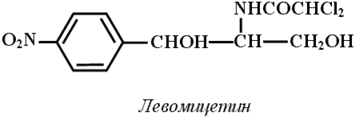
Его содержат ЛВ группы спиртов (спирт этиловый и глицерин); карбоновых кислот и их солей (кальция лактат, пангамат, пантотенат, глюконат и др.); терпенов (ментол, терпингидрат); производных фенилалкиламинов (эфедрина гидрохлорид); соединений стероидного строения (прегнин, прогестерон, метилтестостерон, кортизон и др.); антибиотиков ароматического ряда (левомицетин) и некоторых других групп ЛВ.
На основе свойств спиртового гидроксила в анализе содержащих его ЛВ используются следующие реакции:
- этерификации (образование с кислотами или их ангидридами сложных эфиров);
- окисление до альдегидов (первичные – до альдегидов, иногда кислот; вторичные – до кетонов; третичные – в жестких условиях с разрушением молекулы);
- комплексообразования солями тяжелых металлов (с ионами меди (II) в щелочной среде).
Идентификация
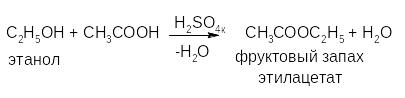
Реакция этерификации в присутствии водоотнимающих средств с кислотами или их ангидридами.
Основана на свойстве спиртов образовывать сложные эфиры. В случае низкомолекулярных соединений эфиры обнаруживают по запаху, при анализе ЛВ с высокой молекулярной массой – по температуре плавления.
Реакция этерификации является фармакопейной для спирта этилового и метилтестостерона.
Реакция окисления
Основана на свойстве спиртов окисляться до альдегидов, которые обнаруживают по запаху. В качестве реагентов используют сильные окислители: калия перманганат, калия бихромат, хлорная кислота, калия перхлорат в кислой среде, гексацианоферрат (III) калия и др. Наибольшую аналитическую ценность имеет калия перманганат, который восстанавливаясь, меняет степень окисления от (+7) до (+2) и обесцвечивается, т.е. делает реакцию наиболее эффектной.
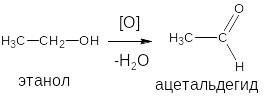
ацетальдегид имеет запах
свежих яблок
Из реакций окисления спиртов наибольший интерес представляет реакция «йодоформной» пробы:
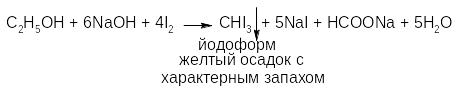
Реакция идет по стадиям:
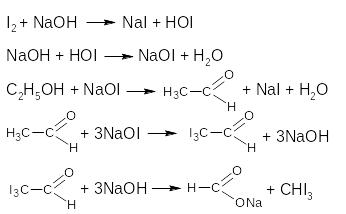
Эта реакция позволяет отличить этиловый спирт от метилового. Но она характерна не только для этанола, но и для веществ, содержащих этокси-группу (-ОС2Н5), альдегидную и ацето-группу.
Окислению могут сопутствовать побочные химические реакции. Например:
- в случае эфедрина (фармакопейная реакция) – гидраминное разложение по схеме:
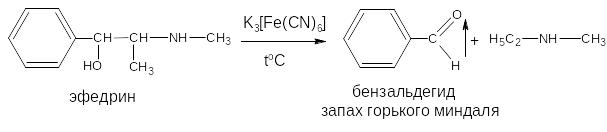
Реакция комплексообразования
Основана на свойстве спиртов образовывать окрашенные комплексные соединения с сульфатом меди (II) в щелочной среде. Избыток щелочи вызывает образование осадка гидроксида меди, маскирующий эффект реакции.
Спирты – это очень слабые кислоты, солей со щелочами они не образуют. На силу кислотных свойств влияют характер заместителя в радикале и число гидроксильных групп в соединении: с увеличением их числа сила кислотных свойств возрастает. Многоатомные спирты вследствие этого способны образовывать внутрикомплексные соединения с солями меди или кобальта в сильнощелочной среде.
Используется для идентификации многоатомного спирта – глицерина:
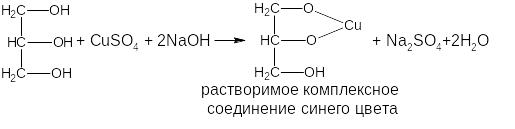
Одноатомные спирты вступают в реакцию комплексообразования, если кроме спиртового гидроксила в соединении содержатся другие электронодонорные группы, способные образовывать координационные связи с металлом (например, эфедрин, левомицетин).
При идентификации эфедрина гидрохлорида кроме спиртового гидроксила в комплексообразовании участвует и вторичная аминогруппа:
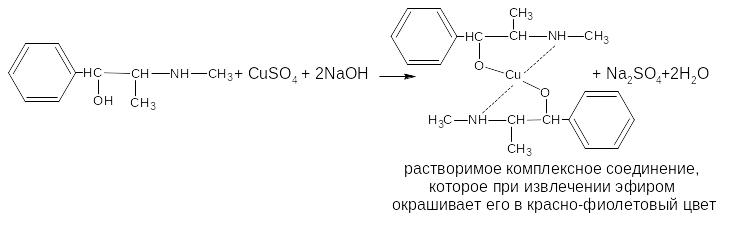
Количественное определение
1.4. Метод ацетилирования: алкалиметрия, вариант нейтрализации, способ косвенного титрования
Основан на свойстве ЛВ за счёт спиртовых гидроксилов ацетилироваться уксусным ангидридом с образованием нерастворимых сложных эфиров и выделением эквивалентного количества уксусной кислоты, которую оттитровывают гидроксидом натрия.
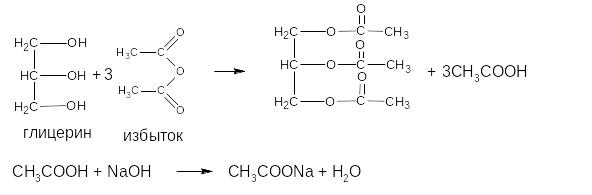
f э. = 1/3
Одновременно будет титроваться также кислота, образованная при гидролизе избытка уксусного ангидрида, взятого для ацетилирования, поэтому необходима постановка контрольного опыта.
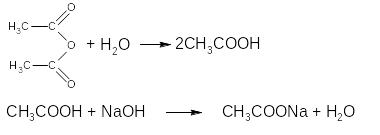
Метод является фармакопейным для ментола.
f=1
1.5. Бихроматный метод
Основан на свойстве ЛВ группы спиртов окисляться бихроматом калия в кислой среде. При этом спирт этиловый окисляется до уксусной кислоты, глицерин – до углекислоты и воды.
Окисление проходит во времени, поэтому используют способ обратного титрования, т. е. вводят избыток титранта – бихромата калия, который затем определяют йодометрически.
3C2H5OH + 2K2Cr2O7 +16HNO3 → 3CH3COOH + 4Cr(NO3)3 + 4KNO3 +11 H2O
спирт этиловый
K2Cr2O7 + 6KI+14 HNO3 → 3I2 + 8KNO3 + 2Cr(NO3)3 + 7H2O
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
f э. = ¼
Фармакопея рекомендует этот метод для определения этилового спирта в хлороформе.
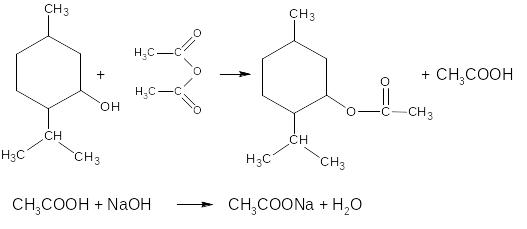
1.6. Куприметрический метод
Основан на свойстве ЛВ, содержащих спиртовой гидроксил, образовывать устойчивые комплексные соединения с сульфатом меди в щелочной среде. Способ прямого титрования: титрант сульфат меди, который стандартизуют йодометрическим методом; индикатор – мурексид.Метод используют во внутриаптечном контроле качества лекарственных форм, содержащих левомицетин.
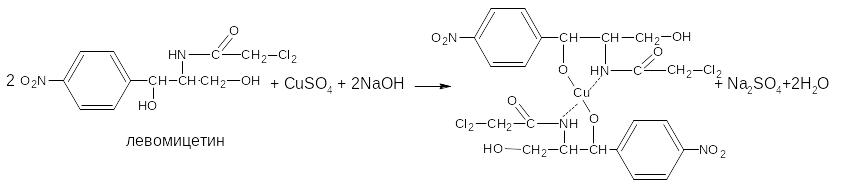
М.э. = 2М.м.
2. Лекарственные вещества, содержащие фенольный гидроксил
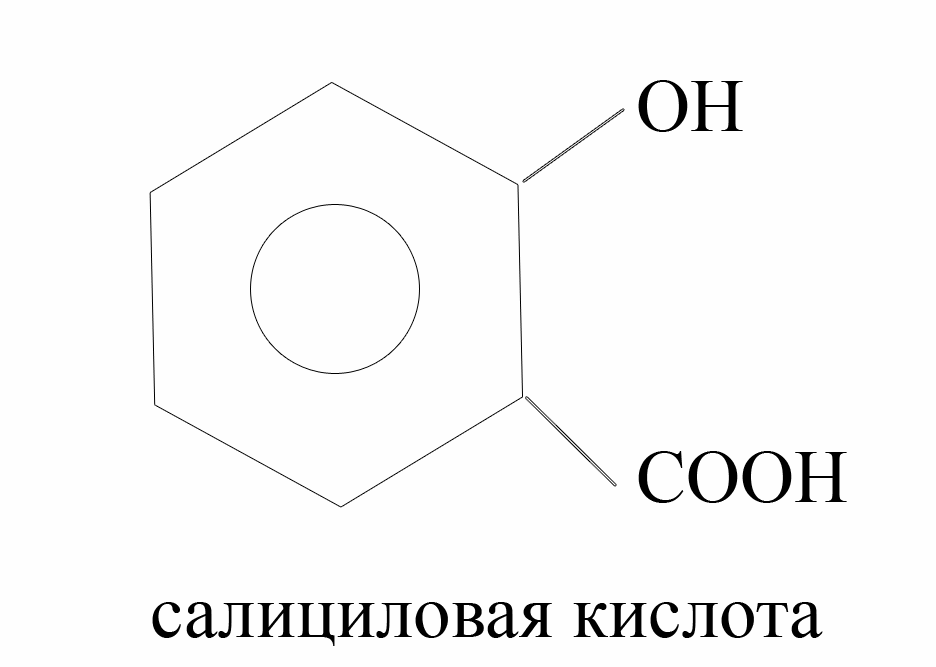
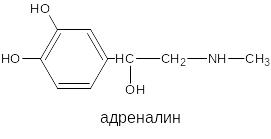
Фенольный гидроксил – это гидроксил, связанный с ароматическим радикалом. Его содержат ЛВ группы фенолов (фенол, резорцин); фенолокислот и их производных (кислота салициловая, фенилсалицилат, салициламид, оксафенамид); производные фенантренизохинолина (морфина гидрохлорид, апоморфин); синэстрол, адреналин и др.
Химические свойства соединений, содержащих фенольный гидроксил, обусловлены взаимодействием электронной пары с π-электронами ароматического кольца. Это взаимодействие приводит к смещению электронной плотности с ОН-группы на кольцо, нарушению в нём равномерности распределения электронов, созданию избыточного отрицательного заряда в орто (о)- и пара (п)-положениях. Атом водорода гидроксигруппы ионизирует и придаёт фенолам слабые кислотные свойства (рКа фенола = 10,0; рКа резорцина = 9,44). Поэтому, в отличие от спиртов, они образуют соли со щелочами (при рН 12-13), растворимые комплексные соединения с хлоридом железа (III) (в нейтральных, слабощелочных и кислых растворах).
Фенолы проявляют сильные восстановительные свойства, очень легко окисляются даже слабыми окислителями. Образуют окрашенные соединения хиноидной структуры.
Наибольшее значение имеют реакции электрофильного замещения водородов в о- и п-положениях ароматического кольца – галогенирование (бромирование), конденсация с альдегидами, нитрование, сочетание с солями диазония.
На основе свойств фенольного гидроксила и активированного им ароматического кольца в анализе ЛВ используются следующие реакции:
1 – комплексообразования;
2 – галогенирования (бромирования);
3 – азосочетания;
4 – окисления;
5 – образования индофенолового красителя;
6 – конденсации с альдегидами.
Идентификация
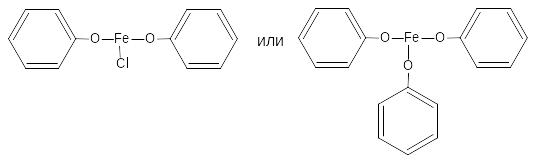
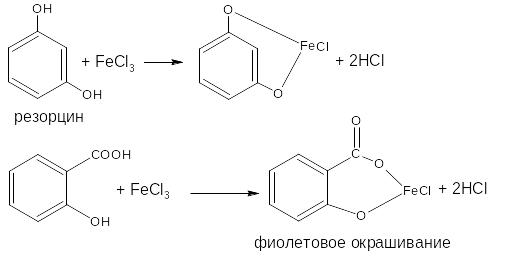
2.1. Реакция комплексообразования с ионами железа (III)
Основана на свойствах фенольного гидроксила образовывать растворимые комплексные соединения, окрашенные чаще в синий (фенол) или фиолетовый цвет (резорцин, кислота салициловая) реже в красный (ПАСК – натрия) и зелёный (хинозол, адреналин).
Состав комплексов, а, следовательно, и их окраска обусловлены количеством фенольных гидроксилов, влиянием других функциональных групп, реакцией среды.
Реакция рекомендована фармакопеей для большинства соединений, содержащих фенольный гидроксил.
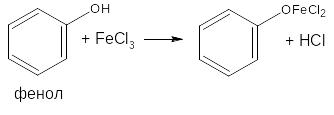
При избытке фенола:
2.2. Реакция бромирования ароматического кольца
Основана на электрофильном замещении водорода в о- и п- положениях на бром с образованием нерастворимого бромпроизводного (белый осадок).
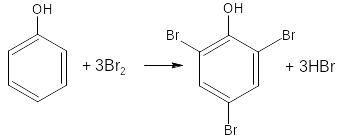
Основные правила бромирования:
- бром замещает водород в о- и п- положениях по отношению к фенольному гидроксилу (наиболее реакционноспособное – п-положение):
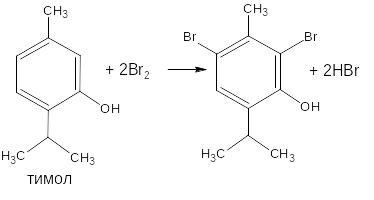
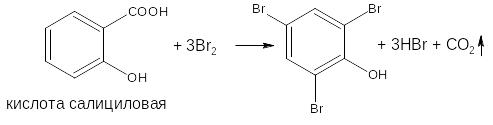
- если в соединении содержится два фенольных гидроксила в м- положении, то в результате их согласованной ориентации образуется трибромпроизводное:
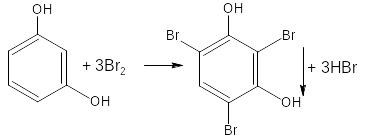
- если две гидроксильные группы расположены в о- или п- положениях друг к другу, то они действуют несогласованно: бромирование количественно не проходит:
- если кроме фенольных гидроксилов соединение содержит амидную или сложно-эфирную группу (салициламид, фенилсалицилат) для их количественной оценки методом броматометрии необходимо провести предварительный гидролиз.
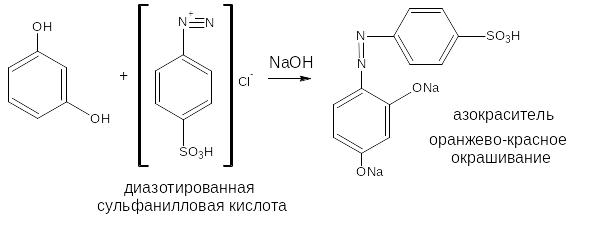
2.3. Реакция азосочетания
Сочетание идет также в о- и п-положениях, в этом случае также, как и при бромировании, предпочтительным является п-положение. Диазореактив – соль диазония (диазотированная сульфаниловая кислота). Среда – щелочная. Продукт реакции – азокраситель.