
- •2. Метод кислотно-основного титрования в среде протофильного растворителя (дмфа) Показать на примере метионина, гидрохлоротиазида (дихлотиазида, гипотиазида), фталилсульфатиазола (фталазола).
- •8. Йодометрия: варианты окисления, восстановления, замещения. Показать на примере водорода пероксида, меди сульфата, натрия тиосульфата, менадиона натрия бисульфита (викасола), кислоты аскорбиновой.
- •9. Йодатометрический и перйодатный методы в применении к анализу лс. Показать на примере кислоты аскорбиновой и глицерола (глицерина).
- •10. Броматометрия: варианты окисления, замещения. Показать на примере калия йодида, тимола, резорцина, гексэстрола (синэстрола).
- •11. Перманганатометрия и цериметрия в применении к анализу лс. Показать на примере магния пероксида, железа (II) сульфата, менадиона натрия бисульфита (викасола).
- •13. Метод ацетилирования в анализе лс. Показать на примере ментола, диэтилстильбэстрола.
- •14. Метод сжигания в колбе с кислородом. Показать на примере галотана (фторотана), бромкамфоры, бромгексина гидрохлорида
- •Определение хлора и брома
1. Метод кислотно-основного титрования в среде протогенного растворителя (безводной уксусной кислоты, уксусного ангидрида). Показать на примере кислоты гамма-аминомасляной (аминалона), натрия цитрата, эпинефрина (адреналина) гидротартрата, лидокаина гидрохлорида.
1.ФС Ацидиметрический метод неводного титрования для субстанции (титрование хлорной кислотой в среде безводной уксусной кислоты). Кислотно–основное титрование. Среда – ледяная уксусная к-та. Титрант – хлорная к-та, растворенная в ледяной уксусной к-те Инд. – кристаллический фиолетовый.
В среде безводной уксусной кислоты подавляются кислотные свойства групп кислотного характера и усиливаются основные свойства групп основного характера.
При растворении в протогенном растворителе - безводной уксусной кислотe цвиттер-ионная форма аминокислоты переходит в катионную.
Растворение препарата:
![]()
Титрант:
![]()
Титрование и регенерация растворителя:

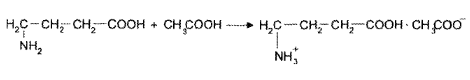
2. натрия цитрат неводное титрование
1. HClO4 + CH3COOH ClO4- + CH3COOH2+
2. натрия цитрат + 3CH3COOH 3Na+ + 3CH3COO- + лимонная кислота
3. CH3COO- + CH3COOH2+ 2CH3COOH
4. Na+ + ClO4- NaClO4
f=1/3
3. адреналин
4 .лидокаина
гидрохлорид
.лидокаина
гидрохлорид
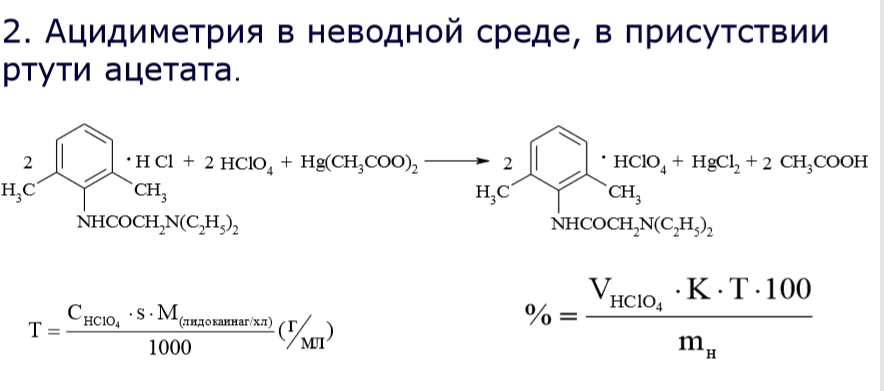
2. Метод кислотно-основного титрования в среде протофильного растворителя (дмфа) Показать на примере метионина, гидрохлоротиазида (дихлотиазида, гипотиазида), фталилсульфатиазола (фталазола).
1.метионин
Алкалиметрический метод нейтрализации в среде органических растворителей: диметилформамида (ДМФА), ацетона, этилового и пропилового спиртов (подавляют ионизацию аминогрупп), титрант - водный раствор натрия гидроксида.
ФС: метионин в субстанции, таблетках, 5% раствор кислоты
аминокапроновой для инъекций.
![]()
Индикатор – для метионина - тимоловый синий (от желтой до синей окраски), растворитель – ДМФА.
Для кислоты аминокапроновой - тимолфталеин (от бесцветного к синему окрашиванию), растворитель – ацетон. f экв.(ЛС) = 1.
2.Количественное определение гидрохлортиазида проводят методом титрования 0,1 М натрия гидроксидом в среде диметилформамида (индикатор – тимоловый синий) или цериметрически
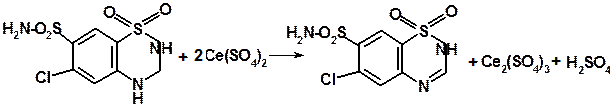
3.фталазол
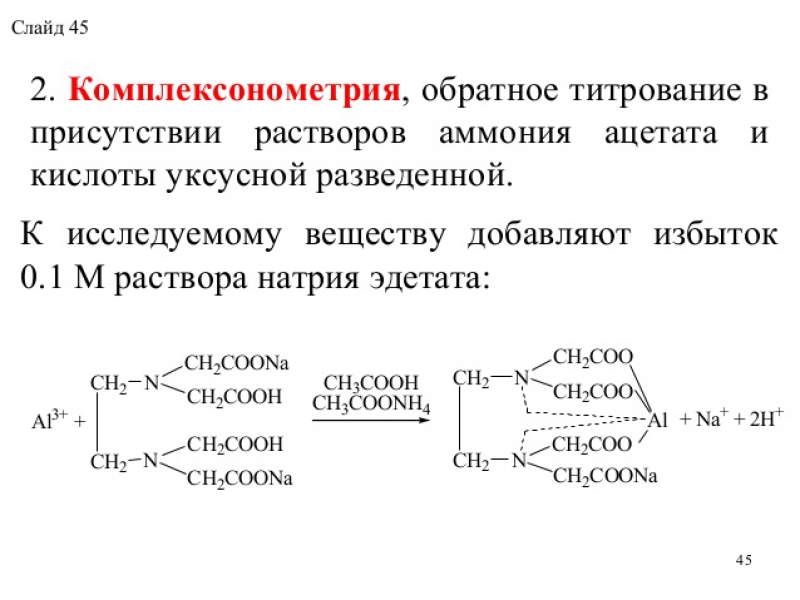
Метод кuслотно-основного титрования (алкалиметрия) в среде протофильного растворителя (диметилформамида). Титрант - раствор натрия гидроксида в смеси метилового спирта и бензола. Индикатор - тимоловый синий. Метод основан на свойстве диметилформамида, обладающего способностью присоединять протон, усиливать кислотные свойства сульфаниламидов. Для кислотных форм сульфаниламидов реакция солеобразования протекает по сульфамидной группе (см. раздел «Химические свойства» ), fэкв.(лв) = 1.
Метод ФС для веществ с блокированной ароматической амино-группой фталазол (фталилсульфатиазол). В этом случае реакция солеобразования основана на кислотных свойствах, обусловленных карбоксильной группой ароматического кольца остатка фталевой кислоты и подвижного водорода сульфамидной группы, fэкв.(фталилсульфатиазола) = 1/2.
растворитель – ДМФА (диметилформамид)
титрант – раствор гидроксида натрия в смеси метанол + бензол
инд. – тимоловый синий.
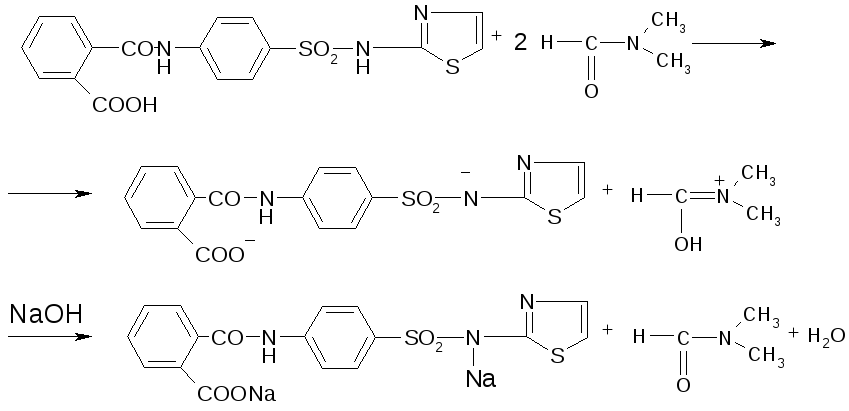
f=1|2
титрант РЧ(1)
3. Аргентометрия в анализе ЛC органической и неорганической природы. Варианты Мора, Фольгарда, Фаянса, Кольтгофа. Титранты, индикаторы, способы фиксации точки эквивалентности. Возможности и ограничения методов. Показать на примере калия хлорида, натрия йодида, хлоралгидрата.
1.калия хлорид



х![]() лоралгидрат
лоралгидрат
4. Комплексонометрия в анализе ЛС. Условия определения и их обоснование: рН среды, способы титрования (прямое, обратное), индикаторы. Показать на примере магния оксида, кальция хлорида, алюминия фосфата.
1. магния оксид
Комплексонометрический метод. Вариант прямого титрования. Метод основан на свойстве ионов магния количественно вступать в реакцию с комплексоном (трилоном Б) с образованием прочных, растворимых в воде, бесцветных внутрикомплексных соединений.
Титрант: раствор трилона Б – динатриевая соль этилендиаминотетрауксусной кислоты (сокращенно – Na2H2ТrБ).
Индикаторы: металлоиндикаторы – органические красители, имеющие различную окраску в свободном виде и виде комплекса с металлом, который менее прочный, чем комплекс трилона Б с металлом. Изменение окраски металлоиндикаторов зависит от pH среды.
Определение солей магния проводят в среде аммиачного буфера при рН 9,5-10,0. Индикатор – кислотный хром черный специальный (эриохром черный Т). Переход окраски от красно-фиолетовой к синей.
Магния оксид предварительно растворяют в кислоте хлороводородной разведенной.
Mg2+ + H2Ind MgInd + 2H+
Окраска раствора за счет
комплекса металла с индикатором
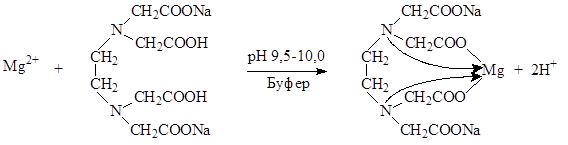
В точке эквивалентности:
MgInd + Na2H2ТrБ MgNa2ТrБ + H2Ind
Окраска раствора за счет
свободного индикатора
fэкв (ЛВ) = 1
2.кальция хлорид
Комплексонометрический метод определения кальция хлорида - основан на свойстве ионов кальция образовывать с трилоном Б прочные, бесцветные, растворимые в воде комплексные соединения.
Титрант - раствор трилона Б.
Индикация - 2 варианта:
А) иникатор - хромовый темно-синий; среда - аммиачный буфер с рН 9,5-10,0. Переход окраски от красной к сине-фиолетовой.
Б) индикатор - кальконкарбоновая кислота; рН среды в конце титрования 12-14. Создается добавлением 30% раствора натрия гидроксида. Переход окраски от розовой к синей.
CaCl2 + H2Ind CaInd + 2HCl
Окраска раствора за счет комплекса металла с индикатором
В точке эквивалентности:
CaInd + Na2H2TrБ CaNa2TrБ + H2Ind
Окраска раствора за счет свободного индикатора
Fэкв(ЛВ) = 1
3. аллюминия фосфат
5. Алкалиметрия: варианты нейтрализации, вытеснения, гидролиза, косвенный. Показать на примере кислоты хлороводородной, кислоты борной, хлоралгидрата, кислоты глутаминовой, кислоты ацетилсалициловой, валидола.
1.кислота хлороводородная
2 .
кислота борная
.
кислота борная
Кислота борная определяется алкалиметрическим методом нейтрализации в присутствии глицерина (нейтрализованного по фенолфталеину). Метод основан на кислотных свойствах кислоты глицеринборной. Индикатор – фенолфталеин.
Уравнение метода:
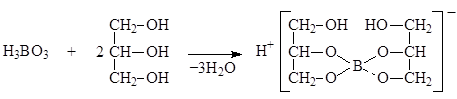
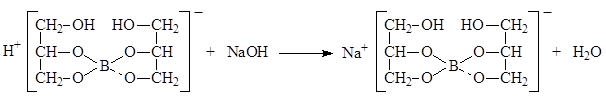
f экв.(кислоты борной) = 1,
3. хлоралгидрат
1. ФС метод обратной алкалиметрии. Метод основан на реакции щелочного гидролитического разложения хлоралгидрата избытком стандартного раствора гидроксида натрия, остаток которого определяется ацидиметрически по фенолфталеину:
![]()
избыток
остаток NaOH + HCl → NaCl + H2O
fэкв (хлоралгидрата) = 1
Проводят контрольный опыт.
4. кислота глутаминовая
1. Алкалиметрический метод (вариант нейтрализации) определения аминокислот, содержащих две карбоксильные группы. При правильном подборе индикатора данные соединения могут титроваться как одноосновные кислоты (карбоксильная группа – в γ-положении).
ФС ХII для кислоты глутаминовой (субстанция и таблетки). Алкалиметрия по бромтимоловому синему до перехода желтой окраски в голубовато-зеленую (рН 6,0 – 7,6) или нейтральному красному.
![]()
Кстех = 1/1; fэкв = 1,
то есть в реакции нейтрализуется одна карбоксильная группа
5. кислота ацетилсалициловая
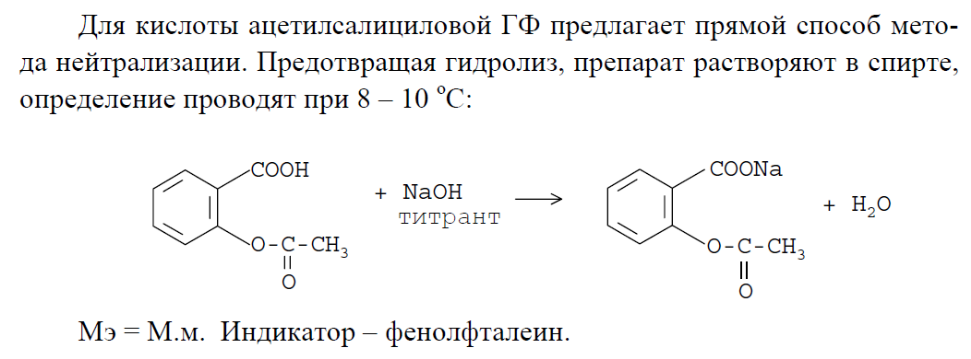
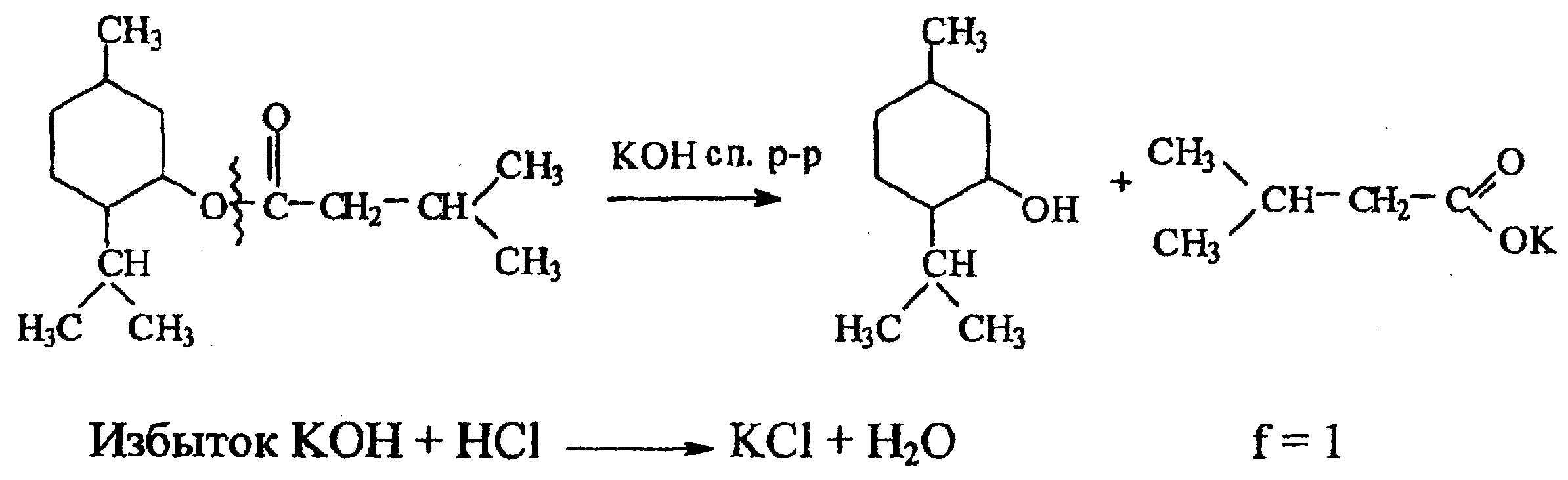
6. валидол
По ГФ X метод алкалиметрии, обратное титрование. Основан на гидролитическом разложении эфира по сложно-эфирной связи в присутствии избытка титрованного спиртового раствора КОН (кипятят 5 часов с обратным холодильником). Образуется спирт – ментол и соль изовалериановой кислоты. Остаток щёлочи определяют ацидиметрически – титруют хлороводородной кислотой по индикатору фенолфталеину до обесцвечивания.
.
.
6. Ацидиметрия: варианты нейтрализации, вытеснения, гидролиза, косвенный. Показать на примере натрия тетрабората, магния оксида, метенамина (гексаметилентетрамина), натрия пара-аминосалицилата, калия ацетата.
1.натрия тетраборат
ацидиметрия, прямое титрование, индикатор – метиловый оранжевый, f = 1/2
Na2B4O7 + 2 HCl + 5 H2O → 4 Н3ВО3 + 2 NaCl
2. магния оксид
По способу обратного титрованиявозможно определение магния окиси:
MgO+ 2HCl→MgCl2+H2O
Э = ½ М.м.
HCl+NaOH→NaCl+H2O
Индикатор метиловый красный
3.метенамин
Ацидиметрия прямая в водной среде. Титруют стандартным раствором кислоты хлороводородной в присутствии смешанного индикатора (метиленовый синий и метиловый оранжевый) как однокислотное основание от зеленого до фиолетового окрашивания.
(CH2)6N4 + HCl → (CH2)6N4· Hcl
fэкв = 1
4. натрия пара-аминосалицилат
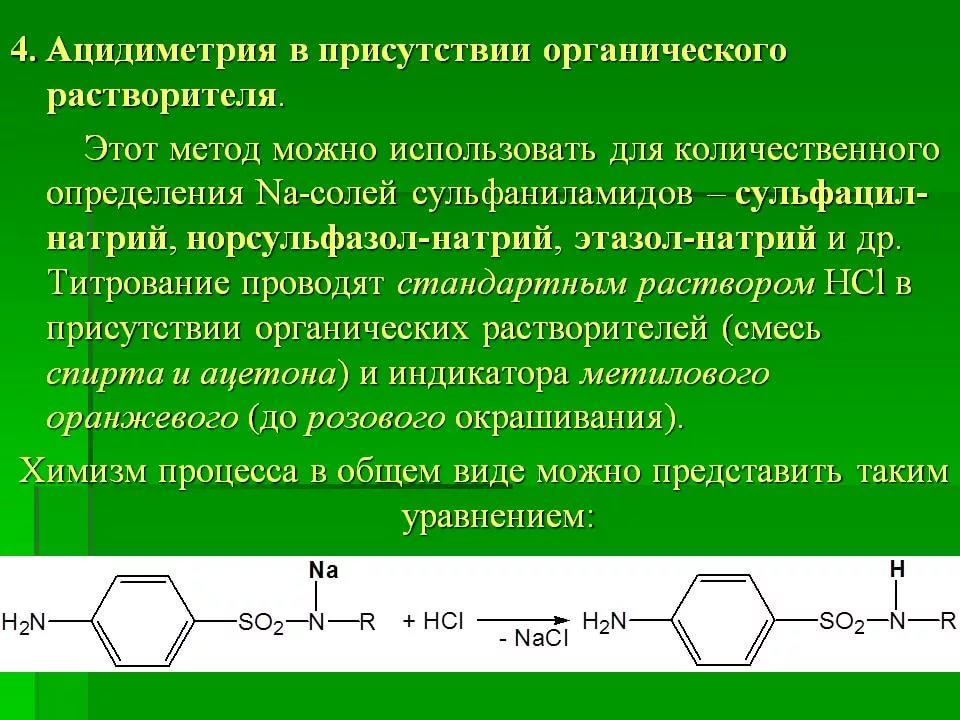
5.калия ацетат

7. Нитритометрия в применении к анализу ЛС, содержащих свободную и замещенную первичную ароматическую аминогруппу, вторичную ароматическую аминогруппу, нитрогруппу. Показать на примере тетракаина гидрохлорида (дикаина), парацетамола, хлорамфеникола (левомицетина).
1.дикаин
нитритометрия, но т.к. дикаин является вторичным ароматическим амином – продукт его взаимодействия с нитритом натрия в среде хлороводородной кислоты N-нитрозопроизводное. Индикатор внутренний – нейтральный красный или тропеолин 00.
2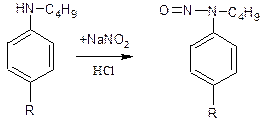 .
парацетамол
.
парацетамол
3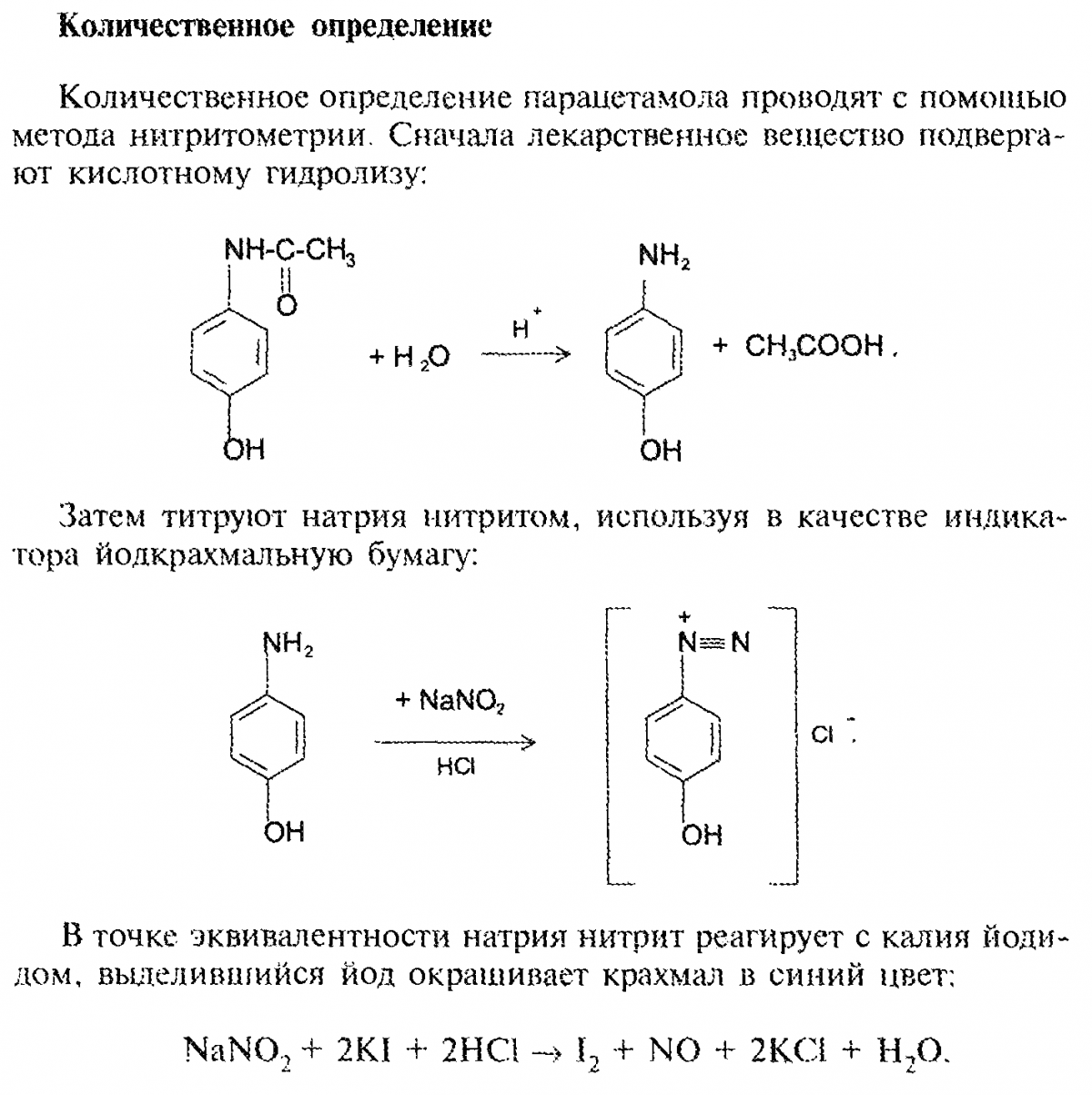 .
левомицетин
.
левомицетин
Нитритометрия (для левомицетина).
Эфиры левомицетина определяют после гидролиза. Предварительно нитрогруппу восстанавливают цинковой пылью в соляной кислоте до первичной ароматической аминогруппы. Затем после охлаждения раствора, продукт диазотируют 0,1М нитритом натрия в присутствии катализатора – КBr. Точку эквивалентности определяют с помощью внешнего индикатора – йодкрахмальная бумага; внутренний индикатор – смесь тропеолина 00 и метиленового синего.
![]()
2KI + 2NaNO2 + 4HCl = I2 + 2NaCl +2KCl + 2NO + 2H2O
