
Травень В.Ф. - Органическая химия. В 3 т. Т. 1
..pdf
362 |
Дополнения |
Некоторые диены предложены для «консервации» солнечной энергии в химических связях. Например, облучение норборнадиена солнечным светом вызывает его изомеризацию до квадрициклана:
hν
t, кат.
норборнадиен квадрициклан
Такая изомеризация сопровождается значительным повышением внутренней энергии молекулы. Избыточная энергия в определенных условиях может быть возвращена и использована при обратном превращении квадрициклана до норборнадиена. Интересно, что способность указанной системы запасать энергию характеризуется значительной величиной — ~1207 Дж/г. Отметим для сравнения, что 1 г воды при нагревании до 50 °С запасает 200 Дж, а 1 г камня — лишь 40 Дж.
Показанный выше механизм зрения подводит к необходимости обсуждения природы поглощения света. Почему многие органические соединения окрашены? Почему одни из них имеют желтый цвет, другие — красный, а третьи — глубокий синий цвет? Ответы на эти вопросы становятся понятными в рамках теории молекулярных орбиталей.
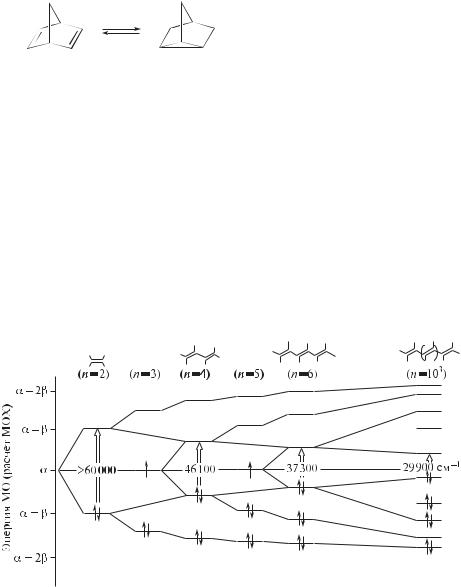
Как показано в разд. 7.4, сопряжение двух С=С-связей в 1,3-бутадиене ведет к заметному сближению граничных электронных уровней в молекуле.
Рис. 7.5. Снижение энергии электронного возбуждения с увеличением числа сопряженных двойных связей в полиене (n – число атомов углерода при сопряженных двойных связях)

Фотохимия. Механизм зрения и природа цвета |
363 |
Таблица 7.1. Максимумы длинноволнового поглощения некоторых ненасыщенных углеводородов
Соединение |
Формула |
|
|
|
|
λмакс, нм (ε) |
|||||||
Этилен |
CH2 |
|
CH2 |
|
|
|
|
171 (15530) |
|||||
|
|
|
|
||||||||||
|
|
|
|
||||||||||
1,3-Бутадиен |
CH2 |
|
CH |
|
CH |
|
|
CH2 |
|
217 (21000) |
|||
|
|
|
|
||||||||||
|
|
||||||||||||
|
|
|
|||||||||||
|
CH2 |
|
CH |
H |
|
|
|||||||
|
|
|
|
||||||||||
|
|
|
|
||||||||||
транс-1,3,5-Гексатриен |
|
|
|
C |
|
C |
|
|
|
CH2 |
274 (50000) |
||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|||||||
|
|
H |
CH |
|
|||||||||
|
|
|
|
|
|||||||||
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Эта закономерность сохраняется при дальнейшем увеличении числа сопряженных связей, что следует, в частности, из энергетической диаграммы, показанной на рис. 7.5.
Чем ближе граничные электронные уровни (Δε) в молекуле органического соединения, тем в более длинноволновой области видимого спектра (ν) оно поглощает свет.
ν (см–1) = 14 800 + 25 400Δε,
где Δε = εНСМО — εВЗМО.
Об этом говорят данные табл. 7.1 и следующие ниже примеры. Значительное число окрашенных полиенов выделено из природных ис-
точников. Например, причиной оранжевого цвета моркови является присутствие в ней β-каротина. Максимум поглощения β-каротина находится при 497 нм.
Как было показано выше, β-каротин имеет 11 сопряженных двойных связей в молекуле и является предшественником витамина А.
Ответственным за красный цвет томатов является лукопрен — соединение, также имеющее 11 сопряженных связей и поглощающее свет при 505 нм.
CH3 |
CH3 |
CH3 |
CH3 |
|
CH3 |
|
|||
|
|
|
|
|
|
CH3 |
CH3 |
CH3 |
CH3 |
|
CH3 |
лукопрен (λмакс 505 нм) |
|
|
Фрагменты молекул, ответственные за поглощение света, получили название хромофоры. Конечно, в качестве хромофоров могут выступать не только сопряженные двойные углерод-углеродные связи. Любая сопряженная система в той или иной мере обладает повышенной способностью по-


ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Абсолютная конфигурация 175, 178 (I) |
Активирующие заместители 71 (II) |
Автоокисление простых эфиров 417 (II) |
Аланин 304, 310 (III) |
Агонисты 117 (II) |
Ализарин 364 (I), 513 (II) |
Адамантан 214 (I) |
Алитам 234 (III) |
Адамс 86 (II) |
Алициклические соединения 31 (I) |
Аденин 261, 300, 328 (III) |
Алкалоиды 199, 200, 204 (III) |
Аденозин 300 (III) |
Алкандиазоний-ионы 193, 194 (III) |
Аденозиндифосфат 300 (III) |
Алканолы 327 (II) |
Аденозинтрифосфат 300 (III) |
Алканы 121 (I) |
Адипиновая кислота 293 (I), 464 (II), 66, |
бромирование 144 (I) |
67, 71, 74, 111 (III) |
галогенирование 144 (I) |
Адреналин 205 (III) |
ионные реакции 156 (I) |
Аза-Анри реакция 158 (III) |
карбоксилирование 155 (I) |
стереоселективная 159 (III) |
межмолекулярные силы 128 (I) |
6Н-1-Азабицикло[4.4.4]тетрадекан |
методы синтеза 125 (I) |
197 (III) |
нитрование 145 (I) |
1-Азабицикло[4.4.4]тетрадец-5-ен |
нитрозирование 155 (I) |
198 (III) |
нормальные 122 (I) |
Азетидин 235 (III) |
окисление 147 (I) |
Азиды карбоновых кислот 228 (III) |
оксимирование 155 (I) |
Азины 462 (II) |
олигомеризация 156 (I) |
Азиридин 235, 236 (III) |
пространственное строение 129 (I) |
Азобензол 146 (III) |
радикальные реакции 135 (I) |
Азоксибензол 146 (III) |
реакции в присутствии соединений |
Азосоставляющие 220 (III) |
переходных металлов 159 (I) |
Азосочетание аренов 88 (II) |
реакции с диборанами 159 (I) |
Азотное правило 197 (II) |
синтез восстановлением галогенал- |
Азулен 33 (II) |
канов 125 (I) |
L-Акозамин, синтез реакцией Анри |
синтез гидрированием алкенов 125 (I) |
156 (III) |
синтез из диалкилкупратов 125 (I) |
Акриловая кислота 82, 91 (III) |
синтез из реактивов Гриньяра 125 (I) |
Акрилонитрил 316 (I), 84 (III) |
синтез по Фишеру–Тропшу 126 (I) |
Акролеин 483 (II) |
синтез реакцией Вюрца 125 (I) |
в реакции Дильса–Альдера 357 (I) |
синтезы промышленные 125 (I) |
Активированный комплекс 100 (I) |
сульфоокисление 147 (I) |
Аксиальный конформер 208 (I) |
сульфохлорирование 146 (I) |
Активированные галогенарены 266, |
температуры кипения и плавления |
270 (II) |
127 (I) |
Активированные электрофилы, реакции |
термолиз 149 (I) |
с алкенами 286 (I) |
фосфонилирование 155 (I) |
370 |
Предметный указатель |
фотоинициирование радикальных |
Альдегиды 431 (II) |
реакций 136, 162 (I) |
автоокисление 465 (II) |
хлорирование 135 (I) |
восстановление 467 (II) |
цепной радикальный механизм |
кето-енольная таутомерия 470 (II) |
136 (I) |
ненасыщенные 481 (II) |
электрофильное галогенирование |
номенклатура 431 (II) |
157 (I) |
получение 433 (II) |
электрофильное нитрование 157 (I) |
рацемизация 473 (II) |
Алкенилбензолы 97 (II) |
реакции 440 (II) |
Алкены 223 (I) |
нуклеофильного присоединения |
галогенирование 233 (I) |
441, 457 (II) |
гидратация 247 (I) |
присоединения–отщепления |
гидрирование гетерогенное 262, 264(I) |
N-нуклеофилов 460 (II) |
гидрирование гомогенное 265 (I) |
спектральный анализ 500 (II) |
гидроборирование 233 (I) |
физические свойства и строение |
гидрогалогенирование 240 (I) |
437 (II) |
изомерия 223 (I) |
Альдер 333, 347 (I) |
номенклатура 223 (I) |
Альдогексоза 278 (III) |
окисление 249 (I) |
Альдоза 278 (III) |
оксимеркурирование 249 (I) |
Альдоль 477 (II) |
получение |
Альдольная конденсация 477 (II) |
восстановлением алкинов 223 (I) |
внутримолекулярная 510 (II) |
дегидратацией спиртов 223 (I) |
направленная 505 (II) |
дегидрированием алканов 225 (I) |
перекрестная 477 (II) |
дегидрогалогенированием дига- |
энантиоселективная 510 (II) |
логеналканов 226 (I) |
Альдоновые (гликоновые) кислоты |
присоединение спиртов 249 (I) |
289 (III) |
радикальное замещение 260 (I) |
Альдотетроза 278 (III) |
радикальное присоединение 257 (I) |
Альдотриоза 278 (III) |
реакции электрофильного присоеди- |
Амбидентные нуклеофилы, в реакциях |
нения 233 (I) |
SN2 250 (II) |
Алкиламины, реакции 191 (III) |
Амидины 227 (III) |
Алкилбензолы 60, 97 (II) |
Амиды карбоновых кислот 30, 32, |
Алкилгидроксониевый ион 341, 342 (II) |
50 (III) |
Алкилирование аренов 47, 59 (II) |
Амилоза 298 (III) |
Алкилсульфонаты 338 (II) |
Амилопектин 298 (III) |
Алкильная группа 28 (I) |
п-Аминобензойная кислота 119 (II) |
Алкины 296 (I) |
β-Аминокарбоновые кислоты 80 (III) |
Алкогольдегидрогеназа, фермент 373 (II) |
Аминокислоты 303 (III) |
Аллен 329 (I) |
бетаинная структура 311 (III) |
Аллиловый спирт 232, 233, 327, 359, 636, |
дезаминирование 316 (III) |
366 (II) |
кислотно-основные свойства 311 (III) |
Аллилфениловый эфир 385 (II) |
классификация 303 (III) |
перегруппировка Кляйзена 398 (II) |
оптическая активность 309 (III) |
Аллилциклопентан 295 (II) |
реакции 311 (III) |
Аллильная перегруппировка 347 (II) |
способы получения 306 (III) |
в реакциях SN1 234 (II) |
энантиоселективный синтез 311 (III) |
Аллильное замещение 261 (I) |
α-Аминокислоты 81 (III) |
О-Аллилфенол 385 (II) |
γ-Аминомасляная кислота (ГАМК) |
масс-спектр 204 (II) |
373 (II) |
Аллокоричная кислота 83 (III) |
1-Аминометилциклогексанол, перегруп- |
Аллоксим, донор NO 161 (III) |
пировка Тиффено–Демьянова 216 (I) |
Альдаровые кислоты 291 (III) |
3-Аминопентановая кислота 80 (III) |




 NH
NH 

 O
O
 ОБРАТИТЕ ВНИМАНИЕ!
ОБРАТИТЕ ВНИМАНИЕ!