
Травень В.Ф. - Органическая химия. В 3 т. Т. 1
..pdf
5.4. Реакции |
261 |
только к замещению атома водорода в аллильном положении на галоген и называется аллильным замещением. Двойная связь при этом в конечном продукте сохраняется.
|
|
|
|
|
|
|
|
α |
+ Cl2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
CH2 |
|
|
CH |
|
|
CH3 |
|
|
|
|
|
|
|
CH2 |
|
CH |
|
CH2Cl |
|||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
> 400 °C, –HCl |
|
|
|||||||||||||||||||||||||||||
пропен |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
аллилхлорид |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
аллильное |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
положение |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
CH3 + Cl2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
CH2 |
|
|
CH |
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
> 400 °C, –HCl |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
α |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
1-бутен |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
CH |
|
|
CH |
|
CH3 + CH2 |
|
CH |
|
CH |
|
CH3 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3-хлор-1-бутен |
|
|
|
|
1-хлор-2-бутен |
||||||||||||||
Реакция протекает как цепной процесс радикального замещения (SR). Высокая температура способствует гомолизу молекулы хлора и образованию радикалов.
Механизм реакции приведен ниже.
Cтадия 1 |
— инициирование цепи: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
Cl |
Cl |
|
|
|
|
|
|
|
|
|
2 Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Стадия 2 |
— развитие цепи (образование аллильного радикала): |
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
CH2 |
|
|
CH |
|
|
|
|
|
|
|
|
+ Cl |
|
|
|
|
[CH2 |
|
|
CH |
|
|
CH2 |
|
CH2 |
|
CH |
|
CH2 ] |
|||
|
|
|
|
|
C |
|
H |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
–HCl |
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
резонансно-стабилизированный аллильный радикал |
||||||||||||||||||
Стадия 3 |
— продолжение цепи: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
CH2 |
|
|
CH |
|
|
|
CH2 |
+ Cl2 |
|
|
|
|
CH2 |
|
CH |
|
CH2Cl |
+ Cl |
и т. д. |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
Предпочтительность аллильного положения в реакциях радикального замещения определяется, таким образом, повышенной устойчивостью стабилизированного резонансом промежуточно образующегося аллильного радикала.
Повышенная стабильность аллильного радикала находит отражение и в значениях энергий соответствующих С—Н-связей. Ниже сравниваются

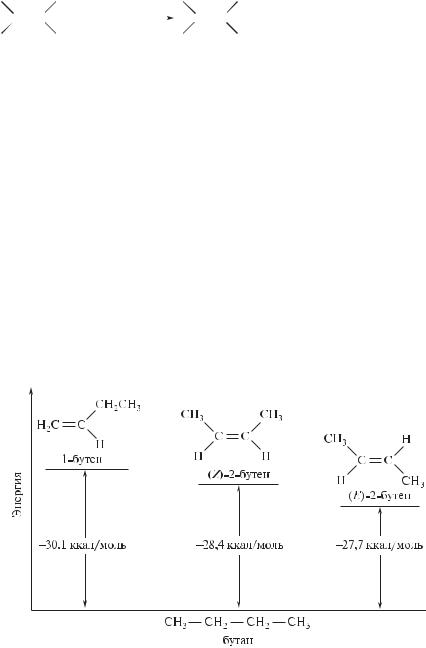

264 |
Глава 5. Алкены |
го алкена. Гидрирование 1-бутена сопровождается наибольшим тепловым эффектом, поскольку этот алкен обладает наибольшим запасом энергии и поэтому является наименее устойчивым. В целом, сравнение теплот гидрирования доказывает, что более замещенные алкены более устойчивы, чем менее замещенные, а транс-изомеры более устойчивы, чем цис-изомеры.
Гетерогенное каталитическое гидрирование
Несмотря на высокую экзотермичность, гидрирование двойной связи не наблюдается в отсутствие катализатора. При гетерогенном гидрировании в качестве катализатора применяют тонкоизмельченные металлы — в чистом виде или нанесенные на инертные носители (ВаSO4, активированнный уголь). Наиболее активные металлы — платина, палладий, рутений и родий — применяются на носителях (Pd/C, Pd/BaSO4, Ru/Al2O3, Rh/C) без давления и температурах не выше комнатной (0–20 °С). Менее активный катализатор — никель — применяют в виде так называемого «никеля Ренея», который получают обработкой сплава Ni-Al горячей водной щелочью для удаления алюминия. В этом случае гидрирование проводят при температуре 50–100 °С и под давлением 5–10 атм. Выдающийся вклад в изучение гидрирования органических соединений в присутствии металлов внес П. Сабатье (Нобелевская премия, 1912 г.).
Гетерогенное гидрирование алкенов протекает на твердой поверхности металла-катализатора. При этом имеет место гетерогенный катализ.
Металлы-катализаторы способны адсорбировать водород и образовывать координационные связи с алкенами. Реакция идет на поверхности металла стереоспецифично как син-присоединение (рис. 5.4).
Рис. 5.4. Схема син-присоединения водорода к алкенам при их гетерогенном каталитическом гидрировании


266 |
Глава 5. Алкены |
5.4.5.Окисление
Окисление алкенов может проходить в нескольких направлениях:
1)с сохранением углеродного скелета молекулы; так протекают эпоксидирование и гидроксилирование двойной связи;
2)с разрывом С=С-связи; так идут озонолиз и исчерпывающее окисление алкенов.
Взависимости от типа окисления применяют различные окислители.
Эпоксидирование
Образование эпоксида (циклического простого эфира) при действии пероксикарбоновой кислоты (или надкислоты) на алкен называют эпоксидированием (реакция Прилежаева, 1909 г.). Пероксикарбоновые кислоты отличаются тем, что аналогично пероксиду водорода содержат простую О—О-связь.
O
R C O OH
Как правило, пероксикарбоновые кислоты весьма неустойчивы и должны храниться при низких температурах. На практике ранее для эпоксидирования чаще других надкислот применяли м-хлорпероксибензойную кислоту. В качестве растворителя пригодны инертные неполярные растворители (бензол, метиленхлорид, хлороформ).
|
|
|
|
|
+ м-ClC H C |
O |
|
|
|
CH |
|
CH |
|
CH |
|
|
|
||
|
|
|
|
|
|||||
|
|
|
|
||||||
3 |
2 |
6 |
4 |
OOH |
(CH2Cl2), 25 °C |
||||
|
пропен |
|
|
||||||
|
|
|
|
|
|||||
м-хлорпероксибензойная кислота
CH |
|
HC |
|
CH |
2 |
+ м-ClC |
H COOH |
|
|
||||||
3 |
|
|
|
|
6 |
4 |
|
|
|
|
O |
|
м-хлорбензойная кислота |
||
пропеноксид |
|
|
|
||||
В настоящее время значительное применение находит монопероксифталевая кислота в виде Mg-соли. Этот реагент можно применять в смесях органических растворителей с водой.
|
|
|
|
O |
||||||||
CH3 |
CH3 |
|
|
O |
|
O |
|
H изо-C3H7OH, H2O |
||||
|
|
|
|
|||||||||
|
|
|
|
|||||||||
C |
|
C |
+ |
|
|
|
|
|
|
|
5 ч, 40 °C |
|
|
||||||||||||
H |
CH |
|
|
O Mg21/2 |
||||||||
|
|
|
3 |
|
|
|
|
|
|
|
|
|
2-метил-2-бутен |
|
|
|
|
|
|
|
|
||||
O |
||||||||||||
|
|
|
|
|||||||||

5.4. Реакции |
|
|
|
|
|
267 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
O |
||
|
|
CH3 |
|
|
O |
CH3 |
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
C |
|
|
C |
|
|
|
|
|
|
O Mg21/2 |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
H |
|
|
|
CH3 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||||
|
|
триметилоксиран (98%) |
|
|
|
|
|
|
|||||
|
|
|
|
|
O |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|||
Эпоксидирование рассматривают как синхронный согласованный процесс, в котором не участвуют ионные интермедиаты. Процесс стереоспецифичен, поскольку его результатом является син-присоединение атома кислорода по одну сторону двойной связи.
R |
R |
1 |
|
O |
|
R |
1 |
H |
|
|
|
|
C |
O |
R |
||||
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|||
|
|
+ R |
|
C |
|
|
|
O |
2 |
|
|
2 |
|
|
C |
|
|||
|
|
|
|
|
|
H |
|
||
H |
H |
|
O |
OH |
|
O |
|||
|
R |
H |
|||||||
|
|
|
|
|
|
||||
R |
1 |
H |
|
|
|
O |
|
C |
|
|
|
||
|
|
+ |
R |
|
C |
|
|
|
O |
2 |
|||
|
|
|
|
|
||
|
|
C |
|
|
|
OH |
R |
|
H |
|
|
|
|
|
|
|
|
|
Гидроксилирование
Известен ряд окислительных реагентов, с помощью которых в мягких условиях возможно присоединение двух гидроксильных групп к алкенам.
Реакция гидроксилирования алкенов, протекающая под действием холодного раствора перманганата калия и сопровождаемая его обесцвечиванием, известна как реакция Вагнера (1888 г.). Она имеет в настоящее время незначительное синтетическое применение, поскольку сопровождается образованием значительного числа побочных продуктов. Однако эта реакция может применяться при изучении строения органического соединения как качественная проба на двойную связь. Гидроксилирование циклогексена действием водного раствора перманганата калия на холоду впервые провел В.В. Марковников. В настоящее время для гидроксилирования алкенов чаще всего применяют оксид осмия(VIII) (реакция Криге, 1936 г.). В качестве растворителя в этом случае возможно применение эфира, бензола, циклогексана, хлороформа. Наилучшие результаты дает применение пиридина, который катализирует реакцию.



270 Глава 5. Алкены
идет с промежуточным образованием эпоксида (подробнее о реакциях эпоксидов см. в т. II, разд. 18.2.2):
|
|
|
|
OH |
|
+ H2O2 |
H2O2 |
|
H |
|
||||
|
(CH3COOH, H2SO4) |
H |
||
|
||||
|
|
|
|
OH |
циклогексен |
транс-1,2-циклогександиол |
|||
транс-1,2-Циклогександиол. К циклогексену (28,9 г; 0,35 моль) при энергичном перемешивании и комнатной температуре медленно прибавляют смесь уксусной кислоты (43,9 г; 0,73 моль), 30%-го пероксида водорода (43,9 г, 0,39 моль) и конц. H2SO4 (4,5 г). Смесь нагревают до полного осветления (2–3 ч), после чего нейтрализуют. Продукт экстрагируют эфиром. Эфир упаривают, получают кристаллы, т. пл. 103–104 °С. Выход 21,5 г (53%).
Гидроксилирование действием пероксида водорода в муравьиной или трифторуксусной кислоте не требует применения Н2SO4.
Задача 5.7. Завершите следующие реакции. Дайте их механизмы. Определите стереохимию хиральных центров в продуктах реакций. Назовите продукты по систематической номенклатуре.
Br2
CCl4
(R)-3-метил-1-пентен
1.OsO4
2.NaHSO3, H2O
Окислительное расщепление алкенов. Озонолиз
Если окисление алкенов щелочным раствором перманганата калия проводить при нагревании, то первоначально образующиеся диолы расщепляются с разрывом С—С-связи. Такую реакцию следует рассматривать как окислительное расщепление алкена. Продуктами окислительного расщепления (в зависимости от строения алкена) являются карбоновые кислоты и (или) кетоны.
R |
R |
[O] |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
C |
|
C |
|
|
2R2C |
|
O |
|
|
|
|
|
|
|
||||||
|
|
R |
t |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
R |
|
|
кетон |
|
|
|
|
|
|
|
|||||||||||
тетразамещенный |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
алкен |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
R |
[O] |
|
|
|
|
|
+ R |
|
|
|
|
|
|
||
R |
|
CH |
|
C |
R |
|
COOH |
|
C |
|
R |
||||||||||
|
|
|
|
|
|
|
|||||||||||||||
|
|
t |
|
|
|
||||||||||||||||
|
|
|
|
|
|
R |
карбоновая |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
O |
|||||||||||
тризамещенный |
|
|
|
кислота |
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
кетон |
|||||||||||||
алкен




 H
H OH
OH H
H