
Травень В.Ф. - Органическая химия. В 3 т. Т. 1
..pdf

254 |
Глава 5. Алкены |
Чтобы обеспечить максимальную региоселективность, работают с про- странственно-затрудненными диалкилборанами:
H
B
|
O |
|
[(CH3)2СHCH(CH3)]2BH |
B H |
|
O |
||
|
бис(3-метил-2-бутил)боран, |
9-борабицикло[3.3.1]- |
пирокатехинборан, |
дисиамилборан (Sia)2BH |
нонан(9-BBN) |
1,3,2-диоксаборол |
Особенно часто применяют дисиамилборан (Sia)2BH: региоселективность гидроборирования 4-метил-2-пентена в этом случае достигает 97%:
|
|
(Sia)2BH |
|
|
В(Sia)2 |
+ |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В(Sia)2 |
|
4-метил-2-пентен |
(97%) |
|
|
(3%) |
|||||
Связь В—С весьма лабильна. Поэтому образующиеся в результате гидроборирования алкилбораны легко подвергаются дальнейшим превращениям. При обработке триалкилборана карбоновой кислотой происходит ацидолиз связей В—С с образованием соответствующего алкана:
R3B + 3HX  3RH + BX3
3RH + BX3
При окислении алкил-боранов пероксидом водорода в щелочной среде при комнатной температуре образуются спирты:
3CH |
|
|
CH |
|
CH |
BH3 |
(CH CH CH ) B |
H2O2 |
3CH CH CH OH |
||||
|
|||||||||||||
|
|
|
|
|
|||||||||
3 |
|
|
|
2 |
3 |
2 |
2 3 |
OH |
3 |
2 |
2 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пропен |
|
|
трипропилборан |
|
1-пропанол |
|||||||
Обрабатывая алкилбораны галогенами в щелочной среде получают галогеналканы. Алкены с концевой двойной связью таким образом удается перевести в первичные алкилгалогениды:
|
CH3 |
CH3 |
||
|
|
|
||
|
|
|
1. BH3, THF |
Br |
|
|
|||
|
|
|
2. Br2/CH3ONa, THF |
|
2-метил-1-пентен |
1-бром-2-метилпентан |
|||
Поскольку образование алкилборана протекает через циклическое переходное состояние, реакцию гидроборирования следует рассматривать как син-присоединение; продуктом такого превращения является цис-аддукт. Важно, что расщепление В–С-связи действием кислот, пероксида водоро-


256 |
Глава 5. Алкены |
Реакция протекает по механизму АdЕ.
Стадия 1 — образование π-комплекса:
CH3 |
|
CH |
|
CH2 + Cl |
|
Cl |
|
|
|
CH3 |
|
CH |
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
пропен |
|
|
|
|
|
Cl |
π-комплекс |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl
Стадия 2 — образование промежуточного карбокатиона (скорость-лимитирую- щая стадия):
CH3 |
|
CH |
|
|
|
|
CH2 |
|
|
CH3 |
|
CH |
|
|
CH2 |
|
CH3 |
|
CH |
|
CH2 |
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
–Cl |
|
|
|
|
|
|
|||||||||
|
|
Cl |
|
|
|
|
Cl |
|
|
|
|
Cl |
|||||||||
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Стадия 3 — взаимодействие промежуточного карбокатиона с водой как нуклеофилом:
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|||
CH3 |
|
CH |
|
|
|
CH2 |
H |
H |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
CH3 |
|
|
CH |
|
CH2Cl |
||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|||||||||||||||||
|
|
|
|
Cl |
|
|
|
|
|
O |
|||||||||||
|
|
|
|
|
|
|
|
|
H |
|
H |
||||||||||
Стадия 4 — депротонирование алкоксониевого иона: |
|||||||||||||||||||||
CH3 |
|
CH |
|
CH2Cl + H2O |
|
|
|
|
|
|
CH3 |
|
CH |
|
CH2Cl + H3O |
||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|||||||||||||||
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
OH |
|||||||
H H |
|
|
|
|
|
|
|
|
|
1-хлор-2-пропанол |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
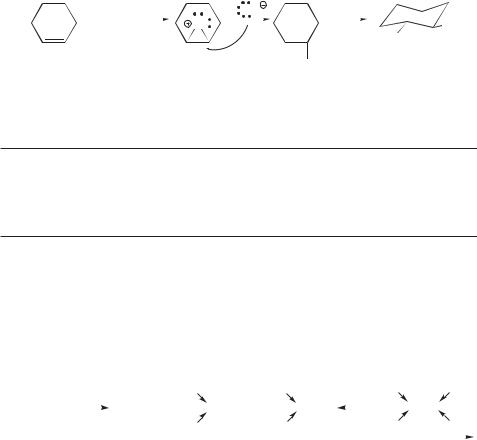
Поскольку хлор обладает высокой электроотрицательностью, открытая форма промежуточного иона представляется более вероятной. В то же время структуру циклического хлорониевого иона промежуточного соединения в этой реакции полностью исключать нельзя.
В частности, известны примеры стереоспецифичного протекания реакции получения хлоргидринов. Об этом говорит, например, факт получения транс-2-хлорциклогексанола с выходом 75% при взаимодействии циклогексена с хлором в водном растворе гидроксида натрия. Этот факт лучше согласуется с циклической структурой хлорониевого иона. Цикл иона раскрывается за счет атаки гидроксид-ионом (или молекулой воды) с тыльной стороны, так что стереохимическим результатом реакции оказывается
5.4. Реакции |
257 |
анти-диаксиальное присоединение. Конечно, образовавшийся (а,а)-хлор- гидрин сразу же принимает (е,е)-конформацию:
|
|
|
OH |
|
|
|
+ Cl2 |
|
Cl |
|
Cl |
|
OH |
20 °C |
|
|
||||
|
|
|
|
|
|
Cl |
циклогексен
OH
(а,а)-транс-2-хлор- (е,е)-конформер циклогексанол
транс-2-Хлорциклогексанол. Раствор хлора в водном растворе едкого натра охлаждают льдом и прибавляют к эквимолярному количеству циклогексена при 15–20 °С. Технический продукт выделяют перегонкой с водяным паром и очищают фракционной перегонкой, т. кип. 87 °С (15 мм рт.ст.). Выход 70–73%.
Завершая обсуждение реакций электрофильного присоединения алкенов, необходимо обратить внимание на следующее.
В ряду гомологов этилена чем более замещенным является алкен, тем выше его реакционная способность в реакциях электрофильного присоединения. Это объясняется тем, что алкильные группы стабилизируют промежуточно образующийся карбокатион или катионоподобные промежуточные частицы.
|
|
|
|
|
|
R |
|
R |
R |
|
|
R |
||||
CH2 |
|
CH2 < R |
|
CH |
|
CH2 < C |
|
CH2 < C |
|
CH |
|
R < |
|
C |
|
C |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
R |
|
R |
R |
|
|
R |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
рост реакционной способности в AdE-реакциях
5.4.2. Радикальное присоединение
Вусловиях, способствующих гомолитическому разрыву связей (газовая фаза, освещение, повышенная температура, присутствие пероксидов), присоединение галогеноводородов к алкенам протекает по радикальному меха-
низму (AdR) против правила Марковникова. В качестве пероксидов применяют пероксид бензоила С6Н5С(О)—О—О—(О)СС6Н5 и гидропероксид трет-бутила (СН3)3СООН.


260 |
Глава 5. Алкены |
Реакция протекает, таким образом, как радикально-цепной процесс. При низких температурах (–80 °С) радикальная реакция бромоводорода с алкеном идет как анти-присоединение вследствие промежуточного образования циклического бромониевого радикала.
В реакциях циклогексена и его производных сначала образуются диаксиальные анти-аддукты.
|
|
|
|
|
|
|
|
Br |
|
|||
|
|
|
|
|
|
|
||||||
|
|
|
Br |
|
Br |
|
HBr |
Br |
||||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
H |
|||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||||
циклогексен |
|
|
|
(а)-бромциклогексан |
(е)-бромциклогексан |
|||||||
В зависимости от наличия других заместителей в молекуле образовавшегося циклогексана первоначальный аддукт принимает наиболее устойчивую конформацию.При комнатной температуре стереоселективность присоединения снижается и образуется смесь цис- и транс-аддуктов.
Другие реакции радикального гидрогалогенирования практического значения не имеют. HCl и HI крайне малоактивны в радикальном присоединении к алкенам в указанных условиях. Связь Н–Сl оказывается слишком прочной к гомолитическому разрыву. Напротив, молекула НI легко образует атомарный иод, который, однако, малореакционноспособен.
Вместе с тем, по радикальному механизму к алкенам могут присоединяться другие соединения, способные к гомолитическому разрыву связей: сероводород, тиолы, дисульфиды, ССl4, СВr4.
+ CBr4 |
hv |
|
|
CBr3 |
75 °C |
|
|||
|
|
|
||
|
|
|
|
|
|
88% |
Br |
||
Задача 5.5. Преимущественным стереохимическим путем радикального присоединения HBr к 5-трет-бутил-1-хлорциклогексену является анти-присоединение. Нарисуйте структурную формулу продукта реакции. Определите стереохимию хиральных центров по R,S-номенклатуре. Дайте полное название продукта по номенклатуре ИЮПАК.
5.4.3.Радикальное замещение
Радикальное присоединение хлора и брома к алкенам протекает быстро и обратимо при невысоких температурах. При повышении температуры выше 200 °С обратная реакция становится столь быстрой, что начинает преобладать тенденция к отрыву атома водорода. Взаимодействие гомологов этилена с галогенами (Cl2, Br2) при высоких температурах (выше 400 °С) ведет

 CH
CH R CH CH
R CH CH CH
CH 2(CH
2(CH ОБРАТИТЕ ВНИМАНИЕ!
ОБРАТИТЕ ВНИМАНИЕ! CH
CH 2(CH
2(CH Br
Br
 Br
Br
 2
2  Br
Br 
 + H Br
+ H Br  R OH + Br
R OH + Br