
Травень В.Ф. - Органическая химия. В 3 т. Т. 1
..pdf
4.5. Стереоизомерия замещенных цилкоалканов |
211 |
транс-1,2-Дихлорциклогексан способен находиться в двух формах (а,а- и е,е-), которые, однако, заметно различаются по энергии. Более устойчивым конформером является (е,е)-транс-1,2-дихлорциклогексан.
Cl |
|
|
|
|
|
H |
|
|
|
H |
Cl |
|
|
|
Cl |
|
|
H |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
Cl |
|
|
|
Cl |
Cl |
|
|
|
H |
|
|
(а,а)-транс-1,2- |
|
|
|
(е,е)-транс-1,2- |
|
дихлорциклогексан |
|
|
|
дихлорциклогексан |
|
Этот изомер также хирален, поскольку его молекула не имеет ни плоскости, ни центра симметрии.
1,3-Дихлорциклогексан
цис-Изомер этого соединения ахирален, так как его молекула имеет плоскость симметрии.
H |
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
Cl |
|
|
|
H |
H |
|
|
|
|
|
|
|
|||
Cl |
|
|
|
Cl |
Cl |
||
|
|
|
Cl |
Cl |
|||
|
|
|
|
||||
|
|
|
|
|
|
||
(е,е)-цис-1,3-дихлор- |
|
|
|
(а,а)-цис-1,3-дихлор- |
|
|
|
циклогексан |
|
|
|
циклогексан |
|
|
|
транс-Изомер хирален, так как не имеет ни плоскости, ни центра симметрии. Однако оба его конформера легко переходят друг в друга, поскольку имеют одинаковую энергию.
Cl |
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
H |
|
|
|
H |
|
Cl |
|
|
|
|
|
|
|||
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
Cl |
|
|
|
Cl |
H |
Cl |
Cl |
|
|
|
|
|
|
(а,е)-транс-1,3-дихлор- |
(е,а)-транс-1,3-дихлор- |
циклогексан |
циклогексан |

Ионные перегруппировки циклоалканов |
213 |
Карбоксилирование циклогексана действием фосгена при облучении дает хлорангидрид циклогексанкарбоновой кислоты c еще большим выходом — до 85% [2]:
|
|
COCl |
|
COOH |
СOCl2, hν |
|
|
||
|
–HCl |
|
|
|
циклогексан |
|
циклогексанкарбоновая |
||
|
|
|
|
кислота |
Каталитическим окислением воздухом или кислородом в зависимости от условий получают циклогексанол, циклогексанон или адипиновую кислоту. Все перечисленные продукты имеют промышленное значение, прежде всего как ценные интермедиаты в производстве полиамидов (подробнее о полиамидах см. в т. III, разд. 20.4).
OH
циклогексанол
O
[O]
циклогексанон
циклогексан
HOOC—(CH2)4—COOH адипиновая кислота
Обратите внимание, что радикальные реакции в ряду циклоалканов протекают с заметно более высокими выходами по сравнению с аналогичными реакциями в ряду линейных алканов. Этот факт объясняется эквивалентностью всех метиленовых групп в молекуле любого моноциклоалкана и равновероятностью по этой причине атаки по каждой из метиленовых групп.
ИОННЫЕ ПЕРЕГРУППИРОВКИ ЦИКЛОАЛКАНОВ
В химии циклоалканов реакции, сопровождаемые перегруппировками, имеют значительное распространение. Как правило, они связаны с превращением тех или иных функций в молекулах циклоалканов и могут рассматриваться при изучении соответствующих классов органических соединений. Вместе с тем все перечисленные ниже реакции протекают с промежуточным образованием ионных интермедиатов и сопровождаются изменением углеродного скелета циклоалкана с расширением или сужени-
Ионные перегруппировки циклоалканов |
215 |
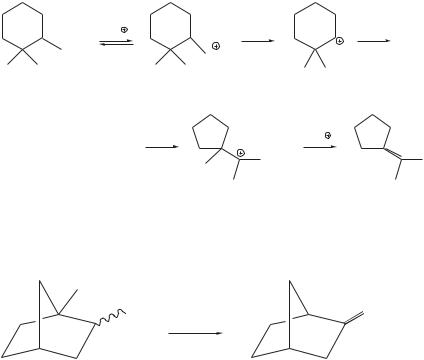
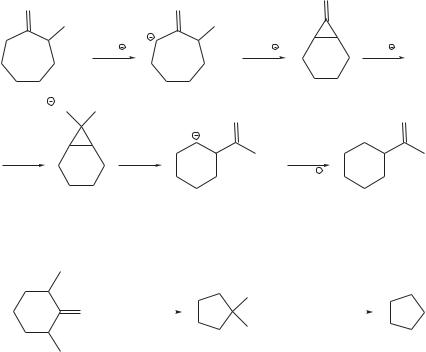
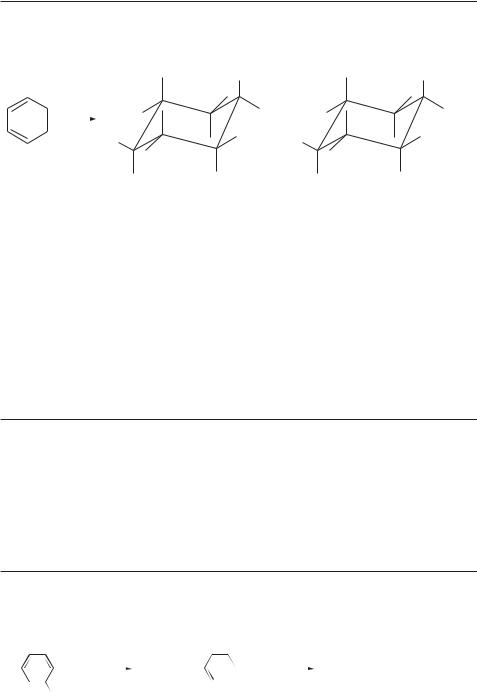
Перегруппировка Вагнера–Меервейна представляет собой изомеризацию скелета молекулы циклоалкана в процессе нуклеофильного замещения, элиминирования или электрофильного присоединения к двойной связи. Такая изомеризация сопровождается миграцией алкильной или арильной группы к соседнему карбокатионному центру [6, 7]. Перегруппировка Ваг- нера–Меервейна протекает, например, при дегидратации 2,2-диметилци- клогексанола с образованием изопропилиденоциклопентана в присутствии минеральных кислот:
+H |
–H2O |
|
OH |
OH2 |
|
CH3 CH3 |
CH3 CH3 |
CH3CH3 |
|
|
–H |
|
CH3 |
CH3 |
|
H |
|
|
CH3 |
CH3 |
Перегруппировки Вагнера–Меервейна особенно распространены в ряду бициклоалканов. Так, при нагревании как эндо-, так и экзо-1-метил-2-нор- борнилового спирта со смесью тозилхлорида и пиридина при 100 °С в течение 12 часов получают 2-метиленбицикло[2.2.1]гептан с выходом 77–85%:
CH3 |
|
OH |
CH2 |
|
Ts—Cl, Py |
|
100 °C |
1-метилбицикло[2.2.1]- |
2-метиленбицикло[2.2.1]- |
гептан-2-ол |
гептан |
Перегруппировки, сопровождаемые изомеризацией углеродного скелета, впервые были открыты Вагнером в 1899 г. при изучении превращений бициклических терпенов и подробно исследованы Меервейном в 1910–1927 гг. Впоследствии название перегруппировок Вагнера–Меервейна было перенесено на перегруппировки и ациклических соединений, протекающие с участием карбокатионных интермедиатов. Кроме миграции алкильных и арильных групп эти перегруппировки могут протекать с миграцией атома Н, ацильной и алкоксикарбонильной групп.

216 |
Для углубленного изучения |
Расширение (или сужение) алицикла на один атом углерода наблюдается и при превращении первичных аминов в спирты действием НNO2 (перегруппировка Демьянова) [8а, б]. Реакция впервые была обнаружена в ряду циклоалканов, но впоследствие распространена и на насыщенные гетероциклические соединения:
H3C CH2NH2 |
|
CH2CH3 |
|
|
|
CH3 |
|
|
NaNO2, |
|
|
|
H3PO4, H2O |
+ |
OH |
|
|
||
|
|
OH |
|
1-метил- |
|
|
|
1-аминометил- |
1-метилцикло- |
1-этилцикло- |
|
циклогексан |
гептанол (67%) |
гексанол (11%) |
|
Частным случаем перегруппировки Демьянова можно рассматривать превращение 1-аминометил-1-циклоалканолов в циклоалканоны, сопровождаемое расширением кольца, при действии НNO2 (перегруппировка Тиф- фено–Демьянова) [9а, б]:
OH
|
HNO2 |
O |
|
|
|
NH2 |
|
|
1-аминометил- |
|
циклогептанон |
циклогексанол |
|
|
Такое превращение протекает и при наличии гетероатома в цикле:
O |
O |
OH |
O |
HNO2 |
|
NH2 |
|
Рассмотренные выше скелетные перегруппировки в ряду циклоалканов протекают с образованием катионных интермедиатов. Менее распространены перегруппировки, сопровождающиеся промежуточным образованием анионов. Перегруппировка Фаворского представляет собой перегруппировку α-галогенкетонов в карбоновые кислоты или их производные под действием оснований. В ряду алициклических соединений
218 Для углубленного изучения
ем 90% цис-1,4-диметилциклогексана и лишь 10% транс-изомера, являющегося термодинамически более устойчивым в (е,е)-конформации:
|
CH3 |
|
|
CH3 |
|
||
|
|
H2 |
, Pd |
|
CH3 |
||
|
|
|
+ |
||||
|
|
|
|||||
|
|
||||||
|
|
|
p, t |
||||
|
|
|
|
H3C |
|
H3C |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|||
п-ксилол |
|
|
(a,е)-цис-1,4-диметил- |
(е,е)-транс-1,4-диметил- |
|||
|
|
|
|
|
|
циклогексан |
циклогексан |
|
|
|
|
|
|
(90%) |
(10%) |
Данный стереохимический результат объясняется механизмом гидрирования на твердой поверхности; адсорбция прохиральной молекулы арена на поверхности катализатора обеспечивает возможность подхода активированной молекулы водорода только с одной стороны. Это и определяет, в конечном счете, цис-ориентацию метильных групп в продукте реакции (подробнее о механизме гидрирования двойной связи на твердом катализаторе см. в гл. 5). В противоположность вышеназванным катализаторам, никель Ренея не обеспечивает стереоселективности гидрирования: при гидрировании диалкилбензолов образуется смесь цис- и транс-изомеров с преобладанием, как правило, транс-изомера.
 ОБРАТИТЕ ВНИМАНИЕ!
ОБРАТИТЕ ВНИМАНИЕ!
Рассмотренная реакция относится к числу стереоселективных реакций. Стереоселективность — это предпочтительное образование в химической реакции
одного стереоизомера по сравнению с другим. Реакции называют на 100% стереоселективными, если образуется только один изомер, и частично (на х%) стереоселективными, если один из стереоизомеров преобладает.
Относительный вклад изомеров может также характеризоваться полуколичественно: как высокая стереоселективность или как низкая стереоселектив-
ность (сравните с понятием «стереоспецифичность», разд. 5.4.1).
Задача 4.7. Завершите реакции. Определите конфигурацию продуктов реакций по R,S-номенклатуре и дайте их названия по систематической номенклатуре ИЮПАК. Изобразите продукты в наиболее устойчивой конформации.
a) |
|
CH3 |
3H2 |
б) |
CH3 |
H2 |
|
|
|
||||
|
|
Ni |
|
Ni |
||
|
|
CH3 |
|
CH3 |
||

 O
O