
- •На тему: Определение нормальной концентрации рабочего раствора тиосульфата натрия
- •1 Этап. Приготовление 100 мл ≈0,02 н раствора дихромата калия (k2Cr2o7)
- •2. Этап. Взаимодействие дихромата калия с избытком иодида калия
- •3 Этап. Титрование выделившегося йода раствором тиосульфата натрия.
- •4 Этап. Расчет точной нормальной концентрации раствора тиосульфата натрия.
2. Этап. Взаимодействие дихромата калия с избытком иодида калия
5. В две конические колбы для титрования на 250 мл отмерьте мензурками ≈10-15 мл раствора KI и ≈10-15 мл 2н раствора H2SO4. Если при смешивании растворов появляется желтая окраска йода, то к полученной смеси аккуратно прилейте одну или две капли раствора тиосульфата натрия до обесцвечивания раствора.
В эти же колбы пипеткой на 10,00, 15,00 или 20,00 мл (Vпип.) возьмите аликвоты приготовленного раствора дихромата калия, предварительно трижды ополоснув пипетку раствором дихромата калия. Закройте колбы крышками и поставьте в темное место на ≈ 5 минут для завершения реакции окисления иодид-иона до йода дихроматом калия.
Затем снимите крышку, ополосните ее над колбой из промывалки, ополосните стенки колбы, и разбавьте содержимое колбы водой приблизительно вдвое для уменьшения интенсивности зеленой окраски соли хрома (III).
3 Этап. Титрование выделившегося йода раствором тиосульфата натрия.
6.Заполните бюретку раствором тиосульфата натрия и установите уровень жидкости на нуле по нижнему мениску.
7.Титруйте выделившийся йод в первой колбе тиосульфатом натрия сначала быстро до светло-желтого цвета без индикатора, затем прилейте 9-10 капель крахмального клейстера и, не доливая бюретки, продолжайте титрование медленно до перехода окраски раствора от голубой до бледно-зеленой. Запишите объем по бюретке (V1) тиосульфата натрия, пошедший на титрование.
8.Аналогично оттитруйте выделившийся йод во второй колбе. Запишите объем по бюретке (V2) Объемы двух параллельных определений (V1 и V2) не должны отличаться друг от друга более чем на 0,20 мл, в противном случае нужно провести еще одно титрование. Рассчитайте среднеарифметический объем Na2S2O3 (Vср(Na2S2O3)), пошедший на титрование аликвот раствора:
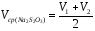 =12.95+13/2=12.975[мл].
=12.95+13/2=12.975[мл].
4 Этап. Расчет точной нормальной концентрации раствора тиосульфата натрия.
9.Расчет результатов анализа основан на законе эквивалентов. Для титрования справедливо соотношение:
nэкв(K2Cr2O7) = nэкв(I2) = nэкв(Na2S2O3) = NNa2S2O3∙Vср(Na2S2O3)
NK2Cr2O7∙VK2Cr2O7 = NNa2S2O3∙Vср(Na2S2O3)
Вычислите нормальность раствора тиосульфата натрия по формуле с точностью до четырех значащих цифр :
N
Na2S2O3=
 =
=
 = 10*0.02669/12.975
=0.02057 [моль(экв)/л]
= 10*0.02669/12.975
=0.02057 [моль(экв)/л]
Вывод: была освоена методика проведения иодометрического анализа, определена нормальная концентрация рабочего раствора Na2S2O3, освоен расчет результатов заместительного титрования в иодометрии.
Покажите преподавателю полученные результаты, оформите отчет о выполненной работе.
Контрольные вопросы
1. Охарактеризуйте окислительно-восстановительную способность пары йод – иодид-ион.
2. Напишите уравнение Нернста для редокс-системы I2/I- и поясните значение входящих в него величин.
3. Каким способом фиксируется точка эквивалентности в методах иодометрии? Привести особенности индикатора.
4. Какие условия (температура, рН и другие) необходимо соблюдать при проведении анализа методом иодометрии? Дать необходимые пояснения.
5. Почему дихромат калия является более удобным исходным веществом для установки концентрации раствора тиосульфата натрия?
6. Привести примеры иодометрического титрования: прямого, обратного и заместительного.
7. Какие из указанных рабочих (стандартных) растворов являются первичными стандартами, а какие – установленными, вторичными: K2Cr2O7, KBrO3, Na2S2O3, I2?
8. Почему рабочий раствор Na2S2O3 нельзя использовать сразу после приготовления? Что происходит с этим раствором при хранении? Привести уравнения соответствующих реакций.
9. Какие установочные вещества (первичные стандарты) используют при стандартизации раствора Na2S2O3? Привести уравнения химических реакций и определить молярные массы эквивалентов.
10. Какие рабочие растворы используют при обратном титровании в методе иодометрии? Привести примеры определений.
11. Как рассчитать точную нормальную концентрацию стандартного раствора дихромата калия, приготовленного по точной навеске?
12. Как по значению нормальной концентрации раствора дихромата калия рассчитать а) титр раствора дихромата калия; б) молярную концентрацию?
20.Как рассчитать точную нормальную концентрацию раствора тиосульфата натрия по результатам иодометрического титрования стандартного раствора дихромата калия?
21.Как по значению нормальной концентрации раствора тиосульфата натрия рассчитать а) титр раствора тиосульфата натрия; б) молярную концентрацию тиосульфата натрия; в) титр раствора тиосульфата натрия по йоду?
