
БТПп2 / химия 3 семестр . Аналитика / лабы / ЛР-1 определение содержания щелочи и статистическая обработка результатов анализа
.docxЛабораторная работа № 1
«Определение концентрации раствора щелочи. Статистическая
обработка результатов анализа»
Цель работы:
- освоить методику проведения титрования
- определить нормальную концентрацию раствора щелочи
- освоить расчет результатов прямого титрования
- произвести обработку результатов анализа, полученных группой,
методами математической статистики
Краткая теория: дайте определения следующих понятий, используя материалы ….
Титрование — Титрование – процесс постепенного контролируемого приливания раствора с точно известной концентрацией к определенному объему другого раствора до т. эквивалентности
Точка эквивалентности — момент титрования, когда число эквивалентов добавляемого титранта эквивалентно или равно числу эквивалентов определяемого вещества в образце.
Рабочий раствор — концентр. 0.1-0.2% должна быть известна до 4х занч. цифр.
рН – индикаторы — органические соединения, способные изменять цвет в растворе при изменении кислотности (pH).
«Нормальная концентрация» — количество эквивалентов данного вещества в 1 литре раствора.
Закон эквивалентов — число моль эквивалентов для всех веществ, участвующих в реакции, одинаково.
Приборы и реактивы: (зарисовать и назвать посуду, указать правила подготовки и работы с посудой)
Методика проведения анализа
1.Бюретку заполнить рабочим раствором кислоты, концентрация которой известна с точностью до 4-х значащих цифр и указана на колбе.
NHCl = 0.0975
2.Чистую пипетку объемом 10,00 или 15,00 мл (Vпип) трижды ополоснуть раствором щелочи.
Vпип =10
3. В две химически чистые конические колбы для титрования пипеткой отобрать аликвоты раствора щелочи, добавить в каждую колбу по 1-2 капли индикатора метилоранжа.
4. Титровать раствор щелочи в первой колбе раствором кислоты, прикапывая ее из бюретки по каплям до перехода желтой окраски в оранжевую. Записать объем израсходованной кислоты по бюретке (V1). Оттитровать раствор щелочи во второй колбе. Записать объем израсходованной кислоты по бюретке (V2).
V1 = 9.65 V2 = 9.8
Объемы параллельных титрований (V1 и V2) не должны отличаться более чем на 0,20 мл. Если объемы параллельных титрований значительно отличаются, необходимо взять еще одну аликвоту раствора щелочи и провести третье титрование.
5. Рассчитать среднеарифметический объем кислоты, пошедшей на титрование.
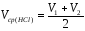 [мл].
V=(9.65+9.8)/2=9.725
мл
[мл].
V=(9.65+9.8)/2=9.725
мл
Составить уравнение реакции, протекающей при титровании
НСl + NаОН → NaСl + Н2О
Расчет результатов анализа
6. По результатам титрования, используя закон эквивалентов, рассчитать с точностью до четырех значащих цифр «нормальную» концентрацию щелочи:
 ,
где N=0.09795*9.725/10=0.09526
,
где N=0.09795*9.725/10=0.09526
NNaOH — нормальная концентрация раствора щелочи NaOH, моль(экв)/л;
NHCl — нормальная концентрация раствора кислоты HCl, моль(экв)/л;
Vср(HCl)— среднеарифметический объем кислоты, пошедший на титрование, мл;
Vпип— объем пипетки для отбора аликвоты раствора щелочи NaOH, мл;
7.Рассчитать с точностью до четырех значащих цифр массу NaOH (г), содержащуюся в 1 л раствора
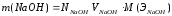 [г],
где m=0.09526*40=3.812
[г],
где m=0.09526*40=3.812
m(NaOH) — масса NaOH, г;
NNaOH — нормальная концентрация раствора щелочи NaOH, моль(экв)/л;
VNaOH— объем раствора щелочи NaOH, л;
M(ЭNaOH) — молярная масса эквивалента NaOH, г/моль(экв).
Статистическая обработка и представление результатов анализа
8. Составить таблицу по результатам титрования всех студентов подгруппы.
|
№ |
Фамилия И.О. студента |
NNaOH |
m(NaOH) |
Примечание* |
|
1 |
Аль-Шишани |
0,09030 |
3,612 |
|
|
2 |
Бикбулатов |
0,08938 |
3,575 |
|
|
3 |
Валиева |
0,08889 |
3,556 |
|
|
4 |
Галин |
0,08864 |
3,544 |
|
|
5 |
Камалова |
0,08839 |
3,536 |
|
|
6 |
Корнаухова |
0,09526 |
3,810 |
Грубый пром |
|
7 |
Макашева |
0,08815 |
3,524 |
|
|
8 |
Рамазанов |
0,08941 |
3,575 |
|
|
9 |
Султанова |
0,08791 |
3,516 |
|
|
10 |
Таспаева |
0,08913 |
3,565 |
|
|
11 |
Фахрутдинова |
0,08718 |
3,487 |
|
|
12 |
Хлыбов |
0,08840 |
3,536 |
|
|
13 |
Чванова |
0,08791 |
3,516 |
|
|
14 |
|
|
|
|
|
*укажите грубый промах, если он есть. |
||||
9. Произвести статистическую обработку результатов, полученных подгруппой, используя материалы []. Привести все расчеты, результаты представить в виде итоговой таблицы.
Итоговая таблица
|
Статистическая характеристика |
NNaOH |
m(NaOH) |
|
xi
|
1.064 |
42.542 |
|
п |
12 |
12 |
|
|
0.08867
|
3.545 |
|
s |
0,0008403 |
0.03366 |
|
∆ |
0.0005337 |
0.02138 |
|
|
0.08867±0.0005337 |
3.545±0.02138 |
|
ε |
0.6019 |
0.60310 |
Полуширина доверительного интервала 3.4641 3.4641
Коэф норм откл 2.2 2.2
Нормальная концентрация.
-
X=1.15895 xср=1.15895/13=0.08915
xi di di^2
|
0,09030 |
|
0,08938 |
|
0,08889 |
|
0,08864 |
|
0,08839 |
|
0,09526 |
|
0,08815 |
|
0,08941 |
|
0,08791 |
|
0,08913 |
|
0,08718 |
|
0,08840 |
|
0,08791 |
0,00023 5,29E-08
0,00025 6,25E-08
0,00051 2,601E-07
0,00076 5,776E-07
0,00611 3,73321E-05
0,001 0,000001
0,00026 6,76E-08
0,00124 1,5376E-06
0,00002 4E-10
0,00197 3,8809E-06
0,00075 5,625E-07
0,00124 1,5376E-06
Сумма=4,81943E-05
2. V=0.00004819/12=0,000004016
3. S=(0,000004016)^0.5=0,0020040
4. 3s=0,006012
5. d6>3s (грубый промах)
6. x(сумма)=1.064
7.
 =xi/n
=1.064/12=0.08867
=xi/n
=1.064/12=0.08867
таблица отклонений без гр промаха
Xi di=xi-xср di^2
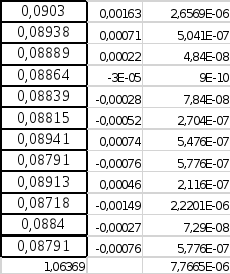
|
8. V=0.000007767/11=0.0000007061 S=(0.0000007061)^0.5=0,0008403 3s=0,002520 Промаха больше нет
∆ n=12 p=0.95 t=2.2
∆
E= 0.0005337*100/0.08867=0.6019
1 Xi= 46,352. |
|
||||||||||||||||||||||||||||||||||||||||||||||
|
2.
3. таблица отклонений Xi di=xi-xср di^2
4. V=di/f=0,07720/12=0,006433
5. S=(0,006433)^0.5=0.08021 6. 3S=0.2406 7. d6> 3s (устраним гр промах)
8. xi=42.542
таблица отклонений без гр промаха Xi di=xi-xср di^2 |
|
||||||||||||||||||||||||||||||||||||||||||||||
|
|
3,612 |
0,067 |
0,004489 |
||||||||||||||||||||||||||||||||||||||||||||
|
|
3,575 |
0,03 |
0,0009 |
||||||||||||||||||||||||||||||||||||||||||||
|
|
3,556 |
0,011 |
0,000121 |
||||||||||||||||||||||||||||||||||||||||||||
|
|
3,544 |
-0,001 |
1E-06 |
||||||||||||||||||||||||||||||||||||||||||||
|
|
3,536 |
-0,009 |
8,1E-05 |
||||||||||||||||||||||||||||||||||||||||||||
|
|
3,524 |
-0,021 |
0,000441 |
||||||||||||||||||||||||||||||||||||||||||||
|
|
3,575 |
0,03 |
0,0009 |
||||||||||||||||||||||||||||||||||||||||||||
|
|
3,516 |
-0,029 |
0,000841 |
||||||||||||||||||||||||||||||||||||||||||||
|
|
3,565 |
0,02 |
0,0004 |
||||||||||||||||||||||||||||||||||||||||||||
|
|
3,487 |
-0,058 |
0,003364 |
||||||||||||||||||||||||||||||||||||||||||||
|
|
3,536 |
-0,009 |
8,1E-05 |
||||||||||||||||||||||||||||||||||||||||||||
|
|
3,516 |
-0,029 |
0,000841 |
||||||||||||||||||||||||||||||||||||||||||||
|
|
42,542 |
|
0,01246 |
||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
сумма di
|
||||||||||||||||||||||||||||||||||||||||||||
9. V=0,01246/11=0.001133
10. S=(0.001133)^0.5=0.03366
11. 3s=0.1010
Di<3s (гр промах устранен)
12.
∆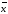 =
=
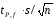
n=12 p=0.95 t=2.2
∆ =2.2*0.03366/3.464=0.02138
=2.2*0.03366/3.464=0.02138
 +-∆
+-∆ =3.545+-0.02138
=3.545+-0.02138
13. E=0.02138*100/ 3.545=0.60310
Вывод: Была освоена методика проведения титрования, определена нормальная концентрация раствора щелочи и масса, а также проведена обработка анализов результатов, полученных группой. В ходе анализа была выявлена грубая ошибка и устранена.

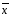
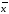
 ± ∆
± ∆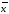
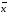 =
=
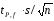
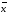 =2.20*0,0008403/3.464=0.0005337
=2.20*0,0008403/3.464=0.0005337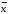 +-∆
+-∆ =0.08867+-0.0005337
=0.08867+-0.0005337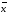 =xi/n
=46.352/13=3.566
=xi/n
=46.352/13=3.566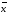 =xi/n
=42.542 /12=3.545
=xi/n
=42.542 /12=3.545