
БТПп2 / химия 3 семестр . Аналитика / лабы / ЛР 8 Корнаухова БТПп-16-01 меди определение
.docxУфимский государственный нефтяной технический университет
Кафедра «Общая, аналитическая и прикладная химия»
Дисциплина «Аналитическая химия»
ОТЧЕТ
по лабораторной работе №8
на тему: Определение содержания меди в контрольном растворе сульфата меди (II)
Выполнил(а)
Студент(ка) группы БТПп-16-01 Корнаухова Д.А Фамилия И.О.
Приняла
доцент кафедры ОАПХ ______________ Чалова О.Б.
Цель работы:
- освоить методику проведения иодометрического анализа
- определить содержание меди (II) в контрольном растворе
- освоить расчет результатов заместительного титрования в иодометрии
Для подготовки к лабораторной работе следует использовать материалы лекций [27-30] и «Введение в йодометрию».
Теоретическое обоснование работы
Медь (II) является довольно слабым окислителем, может восстанавливаться до Cu0 или до Cu1+. Стандартные окислительно-восстановительные потенциалы пар равны:
 0,34
В и
0,34
В и
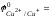 0,17
B.
0,17
B.
Оба
значения меньше потенциала пары
 0,54
B.
0,54
B.
Однако, в присутствии иодид-ионов окислительные свойства иона Cu2+ усиливаются. Происходит это потому, что концентрация иона Cu+ значительно уменьшается из-за малой растворимости образующегося иодида меди (I) (ПРCuI = 10-12). В результате потенциал пары Cu2+/Cu+ становится больше величины 0,54 В. Если концентрация иодид-ионов в растворе равна 10-1 моль/л, то концентрация иона Cu+, найденная из произведения растворимости, равна:
[Cu+] = ПРCuI/[I-] = 10-12/10-1 = 10-11 моль/л
Составим уравнение Нернста для окислительно-восстановительной пары Cu2+/Cu+:
 0,17
+ 0,059lg([Cu2+]/[Cu+])
0,17
+ 0,059lg([Cu2+]/[Cu+])
В присутствии иодид-ионов с концентрацией 10-1 моль/л окислительно-восстановительный потенциал пары Cu2+/Cu+ равен:
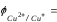 0,17
+ 0,059∙lg([Cu2+]/10-11)
=0,17 - 0,059∙10-11 + 0,059lg([Cu2+])
0,17
+ 0,059∙lg([Cu2+]/10-11)
=0,17 - 0,059∙10-11 + 0,059lg([Cu2+])
Δ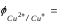 0,808 + 0,059∙lg[Cu2+]
0,808 + 0,059∙lg[Cu2+]
Следовательно,
в этих условиях
 >
>
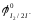 ,
и медь (II) может окислять
иодид-ион до йода.
,
и медь (II) может окислять
иодид-ион до йода.
Иодометрическое определение меди проводится заместительным титрованием. На первой стадии медь (II) взаимодействует с избытком иодида калия по реакции:
2Cu2+ + 4I- = 2CuI + I2
|
2 |
Сu2+ + 1ē = Cu+ |
|
1 |
2I- - 2ē = I2 |
ЭДС
реакции положительна (Δ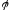 =
=
 -
- >0),
и реакция протекает практически
необратимо.
>0),
и реакция протекает практически
необратимо.
Молярная масса эквивалента меди равна молярной массе меди:
М(ЭСu) = М(Сu) = 63,54 г/моль, так как один атом меди (II) принимает один электрон.
На второй стадии выделившийся йод титруется рабочим раствором тиосульфата натрия:
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
Раствор сульфата меди (II) перед анализом нужно подкислить для подавления реакции гидролиза.
Дайте определения следующих понятий
В качестве стандартного исходного вещества химически чистую медь нельзя использовать для определения нормальности Na2S2O3
Медь (II) проявляет окислительные свойства
Объясниете, почему реакция меди (II) с иодид-ионами возможна Стандартный окислительно-восстановительный потенциал пары φ0Cu2+/Cu+ = 0,17B, меньше потенциала пары φ0I2/2I- = 0,545B. Однако, поскольку в результате реакции образуется труднорастворимый йодид меди(I), концентрация ионов меди(I) уменьшается. В результате окислительно - восстановительный потенциал пары - Cu2+/CuI -увеличивается и оказывается, больше потенциала пары – I2/I-: φCu2+/CuI = 0,865 В > φ0I2/2I- = 0,545 В. возможна и протекает количественн
Для определения меди (II) методом иодометрии проводят титрование методом замещения.
Методика проведения работы
Лабораторная работа состоит из пяти этапов:
1этап. Подготовка контрольного раствора сульфата меди (II).
2 этап. Взаимодействие контрольного раствора сульфата меди (II) с избытком иодида калия
3 этап. Титрование выделившегося йода раствором тиосульфата натрия.
4 этап. Расчет массы меди в контрольном растворе.
1этап. Подготовка контрольного раствора сульфата меди (II).
1.В мерную колбу на 100 мл получите подкисленный неизвестный объем раствора соли меди (II), доведите до метки дистиллированной водой и тщательно перемешайте.
2 этап. Взаимодействие контрольного раствора сульфата меди (II) с избытком иодида калия
2. В две конические колбы для титрования на 100 мл отмерьте мензурками ≈10-15 мл раствора KI и ≈10-15 мл 2н раствора H2SO4. Если при смешивании растворов появляется желтая окраска йода, то к полученной смеси аккуратно прилейте одну или две капли раствора тиосульфата натрия до обесцвечивания раствора.
В эти же колбы пипеткой на 10,00, 15,00 или 20,00 мл (Vпип.) возьмите аликвоты приготовленного контрольного раствора сульфата меди (II), предварительно трижды ополоснув пипетку контрольным раствором. Закройте колбы крышками и поставьте в темное место на ≈ 5 минут для завершения реакции окисления иодид-ионов до йода медью (II).
Затем снимите крышку, ополосните ее над колбой из промывалки, ополосните стенки колбы.
3 этап. Титрование выделившегося йода раствором тиосульфата натрия.
3.Заполните бюретку раствором тиосульфата натрия и установите уровень жидкости на нуле по нижнему мениску.
4.Титруйте выделившийся йод в первой колбе тиосульфатом натрия до светло-желтого цвета без индикатора, затем прилейте 9-10 капель крахмального клейстера и, не доливая бюретки, продолжайте титрование медленно до исчезновения голубой окраски, в колбе остается «молочный» осадок CuI. Вблизи точки эквивалентности реакция замедляется, так как йод адсорбируется на поверхности осадка. Запишите объем по бюретке (V1) тиосульфата натрия, пошедший на титрование.
5.Аналогично оттитруйте выделившийся йод во второй колбе. Запишите объем по бюретке (V2) Объемы двух параллельных определений (V1 и V2) не должны отличаться друг от друга более чем на 0,20 мл, в противном случае нужно провести еще одно титрование. Рассчитайте среднеарифметический объем Na2S2O3 (Vср(Na2S2O3)), пошедший на титрование аликвот раствора:
 =
8.8+8.8/2=8.8[мл].
=
8.8+8.8/2=8.8[мл].
4 этап. Расчет массы меди в контрольном растворе.
6.Расчет результатов анализа основан на законе эквивалентов. Для титрования справедливо соотношение:
nэкв(Cu) = nэкв(I2) = nэкв(Na2S2O3) = NNa2S2O3∙Vср(Na2S2O3)/1000
Масса меди (II) в объеме пипетки рассчитывается по соотношению:
m(Cu) = nэкв(Cu)∙M(ЭCu) = NNa2S2O3∙Vср(Na2S2O3)∙M(Cu)/1000, [г].
Далее рассчитайте массу меди (II), содержащуюся в объеме мерной колбы (Vм.к.), и соответственно в исходном контрольном растворе:
 ,
[г].
,
[г].
Либо вычислите с точностью до четырех значащих цифр массу меди (II) в миллиграммах по формуле:
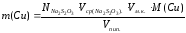 =63.45*0.02057*100*8.8/10=114.9
[мг],
где
=63.45*0.02057*100*8.8/10=114.9
[мг],
где
NNa2S2O3– нормальная концентрация тиосульфата натрия, определенная Вами в лабораторной работе №7;
M(ЭCu) = M(Cu)=63,45 г/моль;
Vср(Na2S2O3) — среднеарифметический объем Na2S2O3, пошедший на титрование аликвот, мл;
Vм.к. — объем мерной колбы, мл;
Vпип. — объем пипетки, мл.
7. Покажите преподавателю полученные результаты, записи в журнале.

Ошибка не должна превышать ±2%. Если она превышает два процента, то необходимо проанализировать выполнение работы и по указанию преподавателя повторить ее. В ходе всей работы необходимо аккуратно вести записи в лабораторном журнале, включая все расчеты.
Оформите отчет о выполненной работе.
Вывод: была освоена методика проведения иодометрического анализа, определено содержание меди (II) в контрольном растворе, освоен расчет результатов заместительного титрования в иодометрии.
Контрольные вопросы
1. Охарактеризуйте окислительно-восстановительную способность редокс-пары Cu2+/Cu+.
2. Напишите уравнение Нернста для редокс-системы Cu2+/Cu+ и поясните значение входящих в него величин.
3. Как объяснить, что медь (II) может окислять иодид-ион?
4. Почему титрование выделившегося йода в ходе анализа меди следует проводить медленно?
5. Почему крахмальный клейстер следует добавлять только в конце титрования вблизи точки эквивалентности?
6. Почему взаимодействие окислителя — меди (II) и иодида калия проводят в темноте в течение не менее 5 минут?
7. Почему перед титрованием следует ополоснуть крышку и стенки колбы?
8. Как рассчитать массу меди по результатам иодометрического заместительного титрования?
9. Предложите методику определения точной концентрации раствора тиосульфата натрия, используя в качестве стандартного вещества химически чистую металлическую медь.
