
БТПп2 / химия 3 семестр . Аналитика / лабы / ЛР 6 Корнаухова БТПп-16-01
.docxУфимский государственный нефтяной технический университет
Кафедра «Общая, аналитическая и прикладная химия»
Дисциплина «Аналитическая химия»
ОТЧЕТ
по лабораторной работе №6
на тему: Определение содержания железа (II) в контрольном растворе
Выполнил(а)
Студент(ка) группы___БТПп-16-01 __________ Корнаухова Д.А
Приняла
доцент кафедры ОАПХ ______________ Чалова О.Б.
Цель работы:
- освоить методику проведения перманганатометрического анализа
- освоить расчет результатов прямого титрования по методу перманганатометрии
- определить содержание железа в контрольном растворе.
Для подготовки к лабораторной работе следует использовать материалы лекций [24-26] и «Введение в перманганатометрию».
Теоретическое обоснование работы
Данная методика применима для определения содержания железа в солях, рудах и технических материалах. Если для анализа дан твердый образец, то его предварительно измельчают и растворяют в соответствующем растворителе, чаще всего в кислоте. Если исследуемый образец или раствор содержит окисленные формы железа (Fe2O3, Fe3O4, Fe3+), их после растворения восстанавливают до железа (II) хлоридом олова (II) в солянокислой среде.
Анализ железа (II) проводят прямым титрованием. Ионы железа (II) легко окисляются перманганатом калия в кислой среде до иона железа (III) по реакции:
Fe2+ + 1e=Fe3+
Молярная масса эквивалента железа равна:
М(ЭFe) = М(Fe) = 55,85 г/моль.
В ходе титрования протекает реакция в соответствии с уравнением:
MnO4- + 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O
Следует учитывать, что возможно протекание побочной реакции между перманганатом и продуктом — ионом Mn2+.
2MnO4- + 3Mn2+ + 2H2O → 5MnO2 + 4H+
Поэтому титрование проводят медленно по каплям, не создавая избытка перманганата калия.
Дайте определения следующих понятий
Конец титрования в перманганатометрии определяют по изменению цвета раствора до бледно-розового.
Анализ проводят в кислой среде
Рекомендуется использовать серную кислоту
Азотную кислоту используют или не используют, так как могут идти конкурирующие окислительно-восстановительные реакции.
Соляную кислоту используют или не используют, так как идёт окисление до хлора.
Прямое титрование проводят для определения концентрации восстановителя.
Обратное титрование восстановителей проводят для определения концентрации, так как они взаимодействуют с перманганатом медленно.
Методика проведения работы
Лабораторная работа состоит из трех этапов:
1 этап. Подготовка контрольного раствора соли железа (II).
2 этап. Титрование раствора железа (II) раствором перманганата калия.
3 этап. Расчет массы железа (II) в контрольном растворе.
1 этап. Подготовка контрольного раствора соли железа (II).
1.В мерную колбу на 100 мл получите неизвестный объем раствора соли железа (II), доведите до метки дистиллированной водой и тщательно перемешайте.
2 этап. Титрование раствора железа (II) раствором перманганата калия
2.Заполните бюретку раствором KMnO4 известной нормальности N(KMnO4) и установите уровень жидкости на нуле по верхнему мениску.
3. В две конические колбочки для титрования (на 100 мл) пипеткой на 10,00 мл (Vпип.) возьмите аликвоты анализируемого раствора железа (II), предварительно трижды ополоснув пипетку раствором железа (II).
В эти же колбы прилейте цилиндром по ≈15 мл 2н. раствора серной кислоты. Нужно добавлять достаточное количество кислоты, так как она нейтрализуется в процессе титрования. В случае недостатка кислоты во время титрования образуется бурый осадок MnO2.
4.Титруйте содержимое первой колбы раствором перманганата при комнатной температуре до появления неисчезающей в течение 30 секунд бледно-розовой окраски. Раствор титранта KMnO4 приливайте с такой скоростью, чтобы капли можно было сосчитать.
Запишите объем по бюретке (V1) перманганата калия, пошедший на титрование.
5.Аналогично оттитруйте железо (II) во второй колбе. Запишите объем по бюретке (V2) Объемы двух параллельных определений (V1 и V2) не должны отличаться друг от друга более чем на 0,20 мл, в противном случае нужно провести еще одно титрование. Рассчитайте среднеарифметический объем KMnO4 (Vср(KMnO4)), пошедшей на титрование аликвот контрольного раствора железа (II):
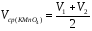 =11.1+11.1/2=11.2[мл].
=11.1+11.1/2=11.2[мл].
3 этап. Расчет массы железа (II) в контрольном растворе
6.Для титрования по закону эквивалентов справедливо соотношение:
nэкв(Fe) = nэкв(FeSO4) = nэкв(KMnO4);
nэкв(KMnO4) = N(KMnO4)·Vср(KMnO4)/1000;
Расчет массы железа (II) в объеме пипетки рассчитывается по соотношению:
m(Fe) = nэкв(Fe)∙M(ЭFe) = N(KMnO4)· Vср(KMnO4)∙M(Fe)/1000, [г].
Далее рассчитайте массу железа (II), содержащуюся в объеме мерной колбы (Vм.к.), и соответственно в исходном контрольном растворе:
 ,
[г].
,
[г].
Либо
вычислите с точностью до четырех значащих
цифр массу железа (II)
в миллиграммах по формуле: =11.1*100*55.85*0.04868/10
=301.8
[мг],
где
=11.1*100*55.85*0.04868/10
=301.8
[мг],
где
N(KMnO4) – нормальная концентрация перманганата калия, определенная Вами в лабораторной работе №5;
M(ЭFe) = M(Fe)=55,85 г/моль;
Vср(KMnO4) — среднеарифметический объем КМnO4, пошедший на титрование аликвот, мл;
Vм.к. — объем мерной колбы, мл;
Vпип. — объем пипетки, мл.
7.Покажите преподавателю полученные результаты, записи в журнале.
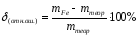
Ошибка не должна превышать ±2%. Если она превышает два процента, то необходимо проанализировать выполнение работы и по указанию преподавателя повторить ее. В ходе всей работы необходимо аккуратно вести записи в лабораторном журнале, включая все расчеты.
Оформите отчет о выполненной работе.
