
БТПп2 / химия 3 семестр . Аналитика / лабы / ЛР 10 Корнаухова БТПп-16-01
.docxУфимский государственный нефтяной технический университет
Кафедра «Общая, аналитическая и прикладная химия»
Дисциплина «Аналитическая химия»
ОТЧЕТ
по лабораторной работе № 10
на тему: Определение содержания ионов кальция и магния
при их совместном присутствии
Выполнил(а)
Студент(ка) группы БТПп-16-01 _____________ Корнаухова Д.А
Приняла
доцент кафедры ОАПХ ______________ Чалова О.Б.
Цель работы:
- освоить методику проведения анализа методом комплексонометрии
- освоить расчет результатов дифференцированного определения ионов кальция и магния по методу комплексонометрии
- определить содержание ионов кальция и магния в контрольном растворе.
Для подготовки к лабораторной работе следует использовать материалы лекций [31-33] и «Введение в комплексонометрию».
Теоретическое обоснование работы
Для дифференцированного определения ионов кальция и магния при совместном присутствии проводят два анализа в различных условиях.
Первый анализ проводится в присутствии хромогена черного в аммиачном буферном растворе. В этом анализе объем ЭДТА расходуется на оба катиона. Взаимодействуют с ЭДТА оба катиона по уравнениям реакций:
Mg2+
+ [H2Y]2-
 [MgY]2-
+ 2H+
[MgY]2-
+ 2H+
Ca2+
+ [H2Y]2-
 [CaY]2-
+ 2H+
[CaY]2-
+ 2H+
По закону эквивалентов для этого титрования выполняется соотношение:
nэкв(Mg2+) + nэкв(Ca2+) = nэкв(ЭДТА) = NЭДТА∙VЭДТА,
где, nэкв(ЭДТА) — количество эквивалентов ЭДТА
NЭДТА — нормальная концентрация ЭДТА, [моль(экв)/л]
VЭДТА — объем раствора ЭДТА, пошедший на титрование в присутствии хромогена черного в аммиачном буферном растворе, л
Второй анализ проводится в присутствии индикатора кальцес (калькон карбоновой кислоты) в растворе гидроксида натрия. В сильно щелочном растворе ион магния осаждается в виде гидроксида магния по уравнению:
Mg2+ + 2OH-
 Mg(OH)2↓
Mg(OH)2↓
Поскольку ион магния перешел в осадок, при титровании с раствором ЭДТА взаимодействуют только свободные ионы кальция по уравнению:
Ca2+ + [H2Y]2-
 [CaY]2- + 2H+
[CaY]2- + 2H+
Катион кальция с индикатором кальцес в растворе образует комплекс малинового (винно-красного) цвета:
Ca2+ + [Ind4-]
 [CaInd]2-
[CaInd]2-
голубой малиновый
В точке эквивалентности окраска раствора становится голубой, так как с ЭДТА взаимодействует комплекс [CaInd]2- по уравнению реакции:
[CaInd]2-
+ [H2Y]2-
 [CaY]2-
+ 2H+
+ [Ind4-]
[CaY]2-
+ 2H+
+ [Ind4-]
малиновый голубой
Во втором анализе в присутствии индикатора кальцес в сильно щелочном растворе объем ЭДТА расходуется только на катионы кальция, следовательно, по закону эквивалентов выполняется соотношение:
nэкв(Ca2+) = n1экв(ЭДТА) = NЭДТА∙V1ЭДТА,
где V1ЭДТА — объем раствора ЭДТА, пошедший на титрование в присутствии индикатора кальцес в сильно щелочном растворе, л.
Таким образом, содержание магния можно рассчитать по соотношению:
nэкв(Mg2+) = nэкв(ЭДТА) - nэкв(Ca2+)
nэкв(Mg2+) = NЭДТА∙VЭДТА - NЭДТА∙V1ЭДТА = NЭДТА∙(VЭДТА - V1ЭДТА).
Дайте определения следующих понятий
Определение суммарного содержания кальция и магния проводят в присутствии хромогена черного в аммиачном буферном растворе Определение кальция проводят в присутствии индикатора кальцес (калькон карбоновой кислоты) в растворе гидроксида натрия.
Методика проведения работы
Лабораторная работа состоит из четырех этапов:
1 этап. Подготовка контрольного раствора солей кальция и магния.
2 этап. Титрование аликвот контрольного раствора в присутствии хромогена черного в аммиачном буферном растворе.
3 этап. Титрование аликвот контрольного раствора в присутствии индикатора кальцес в сильно щелочном растворе.
4 этап. Расчет массы кальция и массы магния в контрольном растворе.
1 этап. Подготовка контрольного раствора солей кальция и магния.
1.В мерную колбу на 100 мл получите неизвестный объем раствора, содержащий соли кальция и магния, доведите до метки дистиллированной водой и тщательно перемешайте.
2 этап. Титрование аликвот контрольного раствора в присутствии хромогена черного в аммиачном буферном растворе.
2. Заполните бюретку рабочим раствором ЭДТА с известной концентрацией: NЭДТА·=0.04708.
3. В две конические колбы для титрования пипеткой на 10,00, 15,00 или 20,00 мл (Vпип.) возьмите аликвоты приготовленного контрольного раствора солей кальция и магния, предварительно трижды ополоснув пипетку контрольным раствором.
В обе колбы прилейте по ≈15 мл аммиачного буферного раствора, добавьте по ложечке индикатора хромогена черного до винно-красной окраски средней интенсивности.
4. Раствор в первой колбе титруйте раствором ЭДТА до тех пор, пока цвет раствора в колбе не станет чисто синим без фиолетового или сиреневого оттенка. В конце титруйте медленно, перемешивая каждую каплю.
5. Запишите по бюретке объем ЭДТА, пошедший на титрование (V1 17.6).
6. Повторите аналогичное титрование во второй колбе. Запишите объем V2 17.6 раствора ЭДТА, пошедший на титрование второй колбы.
7. Рассчитайте среднеарифметический объем (Vср(ЭДТА)) раствора ЭДТА, пошедший на совместное титрование кальция и магния по формуле:
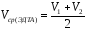 =17.6
мл
=17.6
мл
3 этап. Титрование аликвот контрольного раствора в присутствии индикатора кальцес в сильно щелочном растворе.
8. В две конические колбы для титрования той же пипеткой на 10,00, 15,00 или 20,00 мл (Vпип.) возьмите аликвоты приготовленного контрольного раствора солей кальция и магния.
В обе колбы прилейте по ≈10 мл 1 М раствора NaOH, добавьте по ложечке индикатора кальцес до малиновой окраски средней интенсивности.
9. Раствор в первой колбе титруйте раствором ЭДТА до тех пор, пока цвет раствора в колбе не станет голубого цвета. В конце титруйте медленно, перемешивая каждую каплю.
5. Запишите по бюретке объем ЭДТА, пошедший на титрование (V11=7.3) кальция в растворе.
6. Повторите аналогичное титрование во второй колбе. Запишите объем V12 =7.3 раствора ЭДТА, пошедший на титрование кальция во второй колбы.
7. Рассчитайте среднеарифметический объем (V1ср(ЭДТА)) раствора ЭДТА, пошедший на титрование кальция по формуле:
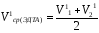 =7.3
мл
=7.3
мл
4 этап. Расчет массы кальция и массы магния в контрольном растворе.
8. Рассчитайте содержание кальция по результатам второго титрования в присутствии индикатора кальцес в сильнощелочном растворе, используя соотношение:
nэкв(Ca2+) = n1экв(ЭДТА) = NЭДТА∙V1ср(ЭДТА),
где V1ср(ЭДТА) — объем раствора ЭДТА, пошедший на титрование кальция в присутствии индикатора кальцес в сильно щелочном растворе, л.
 =0.04708*20.4*7.3*10=68.87
(г)
=0.04708*20.4*7.3*10=68.87
(г)
где M(ЭCa) = ½ M(Ca) =40,08/2 = 20,04 г/моль(экв) — молярная масса эквивалента кальция;
Vм.к. — объем мерной колбы;
Vпип. — объем пипетки, которой отбирали аликвоту.
9. Рассчитайте содержание магния по результатам двух титрований используя соотношение:
nэкв(Mg2+) = nэкв(ЭДТА) - nэкв(Ca2+)
Объем ЭДТА (Vср(ЭДТА на Mg2+)), пошедший на титрование магния равен:
Vср(ЭДТА на Mg2+) = ∙(Vср(ЭДТА) - V1ср(ЭДТА)).
nэкв(Mg2+) = NЭДТА∙(Vср(ЭДТА) - V1ср(ЭДТА)).
 =
=
= 12.5*0.04708*(17.6-17.3)*10=58.918 (г),
где M(ЭMg) = ½ M(Mg) = 24,30/2 = 12,15 г/моль(экв) — молярная масса эквивалента магния;
Vср(ЭДТА) — среднеарифметический объем ЭДТА, пошедший на титрование аликвот в присутствии хромогена черного в аммиачном буферном растворе;
V1ср(ЭДТА)) — среднеарифметический объем ЭДТА, пошедший на титрование аликвот в присутствии индикатора кальцес в сильно щелочном растворе
10. Покажите преподавателю полученные результаты, записи в журнале, получите у него правильный результат (mтеор) и вычислите относительную ошибку (%):
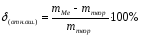
Вывод.Освоена методика проведения анализа методом комплексонометрии; освоен расчет результатов дифференцированного определения ионов кальция и магния по методу комплексонометрии и определено содержание ионов кальция и магния в контрольном растворе.
Контрольные вопросы
1. Какие вещества используются в качесте рабочих растворов в комплексонометрии?
2. Какие реакции протекают при титровании по методу комплексонометрии?
3. От чего зависит устойчивость комплексов ЭДТА с катионами металлов?
4. Почему большинство комплексонометрических титрований проводят в щелочной среде?
5. В каких условиях методом комплексонометрии титруются совместно кальций и магний?
6. В каких условиях методом комплексонометрии титруется кальций?
7. Как по результатам титрования рассчитать содержание кальция в контрольном растворе?
8. Как по результатам титрования рассчитать содержание магния в контрольном растворе?
9. Как проводят прямое титрование по методу комплексонометрии?
10. Запишите закон эквивалентов для прямого титрования по методу комплексонометрии.
