
- •На тему: Определение содержания аммиака в солях аммония методом обратного титрования
- •1 Этап. Подготовка образца соли аммония и удаление nh3 в контрольном растворе образца.
- •2 Этап. Титрование контрольного раствора рабочим раствором кислоты.
- •3 Этап. Контрольное титрование раствора щелочи рабочим раствором кислоты.
- •4 Этап. Расчет содержания аммиака (nh3) в контрольном образце.
Уфимский государственный нефтяной технический университет
Кафедра «Общая, аналитическая и прикладная химия»
Дисциплина «Аналитическая химия»
ОТЧЕТ
по лабораторной работе №3
На тему: Определение содержания аммиака в солях аммония методом обратного титрования
Выполнил(а)
Студент(ка) группы__БТПп-16-01_ ______________ Корнаухова Д.А_
Приняла
доцент кафедры ОАПХ ______________ Чалова О.Б.
Цель работы:
- освоить методику анализа методом обратного титрования (титрования по остатку)
- освоить расчет результатов обратного титрования
- определить содержание аммиака (NH3) в контрольном образце
Для подготовки к лабораторной работе следует использовать материалы лекций [10, 16] и пособия [].
Теоретическое обоснование
Соли аммония в растворе подвергаются гидролизу по катиону и проявляют слабые кислотные свойства:
NH4+
+
H2O
 NH4OH
+ H+
NH4OH
+ H+
Процесс характеризуется константой гидролиза:
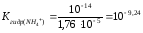 <
10-7.
<
10-7.
Поскольку константа гидролиза очень мала, на кривой титрования соли аммония щелочью скачок отсутствует, и его прямое титрование щелочью с применением рН - индикатора невозможно, то есть невозможно правильно установить точку эквивалентности. Поэтому для определения аммиака (NH3) в солях аммония (NH4+) применяют косвенные методы анализа: обратное титрование или заместительное титрование [см. лекцию].
В данной лабораторной работе анализ проводится методом обратного титрования (титрование по остатку).
Суть этого метода заключается в следующем.
К исследуемому раствору приливают точно измеренное количество рабочего раствора NaOH, которое способно взаимодействовать как с исследуемым веществом NH4Cl, так и с рабочим раствором соляной кислоты (HCl).
Щелочь с раствором соли аммония взаимодействует при нагревании по реакции:
NH4Cl + NaOH → NH3↑ + NaCl + H2O
Остаток щелочи, не вошедший в реакцию с солью аммония, титруется соляной кислотой в присутствии метилового оранжевого.
NaOH(остаток) + HCl → NaCl + H2O
Если концентрация щелочи неизвестна, в ходе анализа проводят контрольное титрование, в котором определяют объем кислоты (VHCl(контр)), необходимый для полной нейтрализации объема щелочи, взятого на анализ (VNaOH).
Дайте определения следующих понятий.
Требования к аналитическим реакциям в количественном анализе
-
проходить при комнатной температуре и атмосферном давлении;
-
протекать с большой скоростью. Желательно, чтобы равновесие устанавливалось как можно быстрее – за несколько секунд или, в крайнем случае, за несколько минут;
-
при установившемся равновесии степень превращения реагирующих веществ должна быть достаточно высокой. Желательно, чтобы реакция проходила количественно, со 100-процентным выходом продуктов (Y);
-
реакция должна соответствовать определенному стехиометрическому уравнению.
Прямое титрование возможно, если есть скачок и удается подобрать индикатор.
Область скачка рН на кривой кислотно-основного титрования зависит от —1. силы кислоты и основания: чем слабее кислоты и основания, тем меньше скачок.. 2. от концентраций растворов: с уменьшением концентрации уменьшается скачок
Скачок на кривой титрования отсутствует если константа равновесия мала Kкисл ≤ 10-7
рН-индикатор выбирают так, чтобы интервал перехода полностью или частично перекрывался скачком титрования.
Суть обратного титрования - (титрование по остатку), когда реакция между веществами А и В протекает медленно или нет подходящего индикатора для фиксирования точки эквивалентности. В этом случае к раствору определяемого вещества А добавляют точно отмеренный, но заведомо избыточный объем титранта В и после завершения реакции между ними остаток вещества В оттитровывают рабочим раствором D
Суть заместительного титрования заключается — (заместительное титрование), когда невозможно провести прямое титрование. В этом случае сначала проводят реакцию определяемого вещества А с избытком вспомогательного реагента D, в результате чего получается соединение А' (заместитель), способное реагировать с титрантом В в строго эквивалентном соотношении
Методика проведения работы
Лабораторная работа состоит из четырех этапов:
1 этап. Подготовка образца соли аммония и удаление NH3 в контрольном растворе образца.
2 этап. Титрование контрольного раствора после удаления NH3 рабочим раствором кислоты.
3 этап. Контрольное титрование раствора щелочи рабочим раствором кислоты.
4 этап. Расчет содержания аммиака (NH3) в контрольном образце.
