
- •На тему: Определение содержания аммиака в солях аммония методом обратного титрования
- •1 Этап. Подготовка образца соли аммония и удаление nh3 в контрольном растворе образца.
- •2 Этап. Титрование контрольного раствора рабочим раствором кислоты.
- •3 Этап. Контрольное титрование раствора щелочи рабочим раствором кислоты.
- •4 Этап. Расчет содержания аммиака (nh3) в контрольном образце.
3 Этап. Контрольное титрование раствора щелочи рабочим раствором кислоты.
8. Если концентрация щелочи (NNaOH) неизвестна, то нужно провести контрольное титрование. В две колбы для титрования из бюретки прилейте точно 15,0 мл раствора щелочи (NaOH) и оттитруйте ее рабочим раствором соляной кислоты (HCl) в присутствии метилового оранжевого до перехода окраски от желтой до оранжевой. Определите по бюретке объемы HCl, пошедшие на титрование обеих колб (V11, V21), и найдите среднеарифметическое значение (Vср),
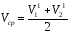 =(14.15+14.15)/2=14.15[мл]
=(14.15+14.15)/2=14.15[мл]
Затраченный объем кислоты (Vср) пошел на титрование 15,0 мл раствора щелочи, а на реакцию с солью аммония брали 30 мл раствора щелочи.
Рассчитайте объем кислоты, который пойдет на титрование 30 мл щелочи, которое было взято на реакцию с солью аммония (VHCl(контр)).
VHCl(контр) = 2∙Vср =14.15*2=28.3[мл]
4 Этап. Расчет содержания аммиака (nh3) в контрольном образце.
9. Рассчитайте процентное содержание аммиака в навеске.
Щелочь (NaOH) расходуется на взаимодействие с двумя веществами (NH4Cl и HCl), поэтому для титрования справедливо соотношение:
nэкв(NaOH) = nэкв(NH4Cl) + nэкв(HCl),
Следовательно: nэкв(NH3) = nэкв(NH4Cl) = [nэкв(NaOH) - nэкв(HCl)];
nэкв(HCl) = NHCl·Vср(HCl)/1000;
nэкв(NaOH) = NNaOH·VNaOH/1000= NHCl·VHCl(контр)/1000.
Таким образом:
nэкв(NH3) = [NHCl·VHCl(контр) - NHCl·Vср(HCl)]/1000;
nэкв(NH3)=NHCl[VHCl(контр-Vср(HCl)]/1000= =0.10804(28.312.31)/1000=0.001728 [моль(экв)]
Рассчитайте массу аммиака (m(NH3)) в исходной навеске с учетом пересчета на объем мерной колбы по формуле:
m(NH3) = nэкв(NH3)·M(ЭNH3)∙Vм.к./ (Vпип.)=17.03*0.001728*100/20
=0.1471 [г],
где M(ЭNH3) =17,03 г/моль – молярная масса эквивалента NH3;
Vпип. — объем пипетки, мл;
Vм.к. — объем мерной колбы, мл.
Рассчитайте массовую долю (%) аммиака в исходной навеске по формуле:
 =(0.1471/0.7594)*100=19.370%
=(0.1471/0.7594)*100=19.370%
Расчет можно проверить по общей формуле:

10. Покажите преподавателю полученный результат, оформите отчет о выполненной работе.
Вывод: была освоена методика анализа метода обратного титрования (титрования по остатку), освоен расчет результатов обратного титрования, определено содержание аммиака (NH3) в контрольном образце.
