
- •Глава 1. Строение и свойства материалов
- •1.1. Кристаллические и аморфные тела
- •1.2. Элементы кристаллографии
- •1.2.1. Кристаллическая решетка
- •1.2.2. Кристаллографические плоскости
- •1.2.3. Анизотропия
- •1.3. Влияние типа связи на структуру и свойства кристаллов
- •1.3.1. Взаимодействие частиц в кристаллах
- •1.3.2. Молекулярные кристаллы
- •1.3.3. Ковалентные кристаллы
- •1.3.4. Металлические кристаллы
- •1.3.5. Ионные кристаллы
1.3.5. Ионные кристаллы
В сложных кристаллах, состоящих из элементов различной валентности, возможно образование ионного типа связи. Такие кристаллы называют ионными.
При сближении атомов и перекрытии валентных энергетических зон между элементами происходит перераспределение электронов: электроположительный элемент теряет валентные электроны, превращаясь в положительный ион, а электроотрицательный — приобретает их, достраивая тем самым свою валентную зону до устойчивой конфигурации, как у инертных газов. Таким образом, в узлах ионного кристалла располагаются ионы. Представитель этой группы — кристалл FeO, решетка которого состоит из отрицательно заряженных ионов кислорода и положительно заряженных ионов железа.
Для ионных кристаллов координационное число определяется соотношением радиусов металлического и неметаллического ионов, так как каждый ион стремится притянуть к себе как можно больше ионов противоположного знака. В решетке ионы укладываются как шары разных диаметров. Радиус неметаллического иона больше радиуса металлического, и поэтому металлические ионы заполняют поры в кристаллической решетке, образованной ионами неметалла. В ионных кристаллах координационное число определяет число ионов противоположного знака, которые окружают данный ион.
Приведенные ниже значения отношений радиуса металла Лм к радиусу неметалла RHM и соответствующие им координационные числа вытекают из геометрии упаковки шаров разных диаметров:
К
RM/RNM 1—0,73 0,73—0,41 0,41—0,22 0,22
Д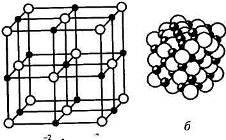 ляFeO
координационное число будет равно
6, так как указанное соотношение равно
0,54. На рис. 1.13 приведена кристаллическая
решетка FeO.
Ионы кислорода образуют ГЦК решетку,
ионы железа занимают в ней поры.
ляFeO
координационное число будет равно
6, так как указанное соотношение равно
0,54. На рис. 1.13 приведена кристаллическая
решетка FeO.
Ионы кислорода образуют ГЦК решетку,
ионы железа занимают в ней поры.
Рис.1.13 Кристаллическая решётка FeO
Каждый ион железа окружен шестью ионами кислорода, и, наоборот, каждый ион кислорода окружен шестью ионами железа. В связи с этим в ионных кристаллах нельзя выделить пару ионов, которые можно было бы считать молекулой. При испарении такой кристалл распадается на молекулы.
При нагреве соотношение ионных радиусов может изменяться, так как у неметалла он возрастает интенсивнее, чем у металла. Это приводит к изменению типа кристаллической структуры, т.е. к полиморфизму. Например, у оксида Fе2О3 при нагреве шпинельная кристаллическая решетка изменяется на ромбоэдрическую решетку.
Энергия связи ионного кристалла по своему значению близка к энергии связи ковалентного кристалла и превышает энергию связи металлического и тем более молекулярного кристаллов. В связи с этим ионные кристаллы имеют высокие температуру плавления и модуль упругости и низкие коэффициенты сжимаемости и линейного расширения. Заполнение энергетических зон вследствие перераспределения электронов делает ионные кристаллы полупроводниками или диэлектриками.
